Как пользоваться таблицей растворимости химических веществ
Растворимость веществ в химии
Растворимость — способность вещества создавать с иными химическими веществами однородные системы, которые называются растворами. В растворах вещество существует в форме отдельных ионов, атомов, молекул, а также частиц.
Растворимость выражается посредством концентрации растворенного вещества в насыщенном растворе или же в процентах, или же в объемных и в весовых единицах, которые относятся к 100 граммам или 100 \(см^{3}\) растворителя (г/100 грамм или \(см^{3}/100 см^{3}\)).
Растворимость газообразных веществ в жидкости всегда зависит от давления и температуры. Растворимость твердых и жидких веществ зависит почти всегда только от температуры. Все вещества в разных степенях являются растворимыми в растворителях. В том случае, когда растворимость является крайне малой для измерения, идет речь о том, что вещество полностью нерастворимо.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Зависимость степени растворимости веществ от температуры проявляется при помощи кривых растворимости. При помощи кривых растворимости совершают разные расчеты. К примеру, возможно определить массу вещества, которое оседает из насыщенного раствора в случае охлаждения.
Кристаллизация — процесс отделения твердого вещества из насыщенного раствора в случае понижения температуры. Кристаллизация имеет большое значения для природных процессов — она приводит к тому, что многие кристаллы на Земле образуются, а также участвует в процессах, которые происходят в горных породах.
Способы выражения характеристик растворимости
Существует два вида характеристик растворимости: качественные, а также количественные.
Качественные характеристики формируют мнение различных исследователей в отношении способности к растворению у данного вещества — плохо растворимо, хорошо растворимо, нерастворимо, мало растворимо и т.д. Они являются субъективными. Более объективными их пытались сделать в Государственной фармакопее СССР для того, чтобы обозначить растворимость различных лекарственных средств, однако она не распространилась широко.
Количественные характеристики обуславливают количество вещества, которое растворяют в данном количестве растворителя при определенных условиях, обычно соразмерно концентрации (моль/л, г/100 грамм растворителя, г/кг растворителя, мольная доля и так далее). Количественную и качественную растворимость обычно приводят в качестве информации в справочниках.
Влияние условий на растворимость
Для того, чтобы определить качественную растворимость используют эмпирическое правило «подобное растворяется в подобном». Данное правило разные источники объясняют по-разному: полярные вещества хорошо растворяются в полярных растворителях, а вещества, которые имеют гидроксильные группы, могут растворяться в растворителях с гидроксильными группами и т.д.
Растворимость находится в прямой зависимости от:
- Растворителя.
- Растворяемого вещества.
- Температуры.
- Давления.
- Наличия в растворителе иных веществ.
Уровень растворимость большей части газов возрастает с ростом давления, а также уменьшается с ростом показателей температуры. Для жидких и твердых веществ влияние на растворимость является менее значимым, чем для газов. Температура же обладает разным влиянием на разные системы «растворитель — растворяемое вещество», однако в большей части случаев с тем, что растет температура, начинает расти и растворимость (у многих солей кальция наблюдается обратная зависимость). Так как вещество, которое растворяется, часто увеличивает температуру кипения растворителя, тогда растворимость при атмосферном давлении можно измерить выше температуры кипения растворителя.
В случае повышенного давления и температуры растворимость способна сильно расти (к примеру, в воде при температуре или высоком давлении хорошо растворяются кварц, углеводороды, они практически не растворяются при нормальных условиях).
Нахождение в растворителе иных веществ может значительно повлиять на растворимость. К примеру:
- Добавление в водный раствор неполярных веществ солей может вести к тому, что выделится неполярное вещество в качестве осадка из-за эффекта высаливания.
- Существование растворенного кислорода значительно влияет на способность ртути растворяться в воде из-за того, что существует эффект поверхностного окисления.
- Существование малого количества влаги в рамках абсолютного этанола способно значительно поменять растворимость многих неполярных веществ.
Растворимость вещества во многом зависит от разных факторов: характера растворителя и вещества, от температурного режима, давления, агрегатного состояния.
Самый главный растворитель — вода. Однако не все вещества (в особенности органические) способны растворяться в воде. Для того, чтобы их растворить применяют разные растворители типа спирта, ацетона, бензола, хлороформа, эфира, метанола и так далее. Используются также смеси различных растворителей. К примеру, смеси спирта с водой.
Для растворения твердого веществ его мелко измельчаются (толкут в ступке или мелят в мельнице). Это делают затем, чтобы увеличить процент соприкосновения поверхности растворяемого вещества, а также растворителя. В процессе взбалтывания или перемешивания ускоряются процессы формирования раствора. При этом часто на емкость, в которой происходит приготовление раствора, надевается обратный холодильник. Это устройство используется для приготовления растворов при помощи кипячения. Уменьшаются потери растворителя. Формируются пары в процессе нагревания, но они выходят осадком, стекают обратно.
Растворимость бывает:
- Ограниченная (соль и вода) — конкретное количество вещества.
- Неограниченная (спирт, вода, калия бромид и калия хлорид) — смешиваются в любых пропорциях.
По степени своей растворимость вещества разделяются на:
- Хорошо растворимые (при 20 градусах по цельсию более 1 грамма).
- Малорастворимые (при 20 градусах по цельсию от 0, 01 до 1 грамма).
- Нерастворимые (растворимость при 20 градусах по цельсию не более 0,01 грамма).
Хорошо растворимым считается вещество, если более 10 г его хорошо растворяется в 100 г воды. Малорастворимым называют вещество, если в 100 г воды его растворяется менее 1 г. И нерастворимые — это такие вещества, менее 0,01 г которых переходит в раствор. Совсем нерастворимых веществ не существует. Даже когда воду наливают в стеклянный сосуд, то незначительная часть молекул стекла переходит в раствор.
Как определяется растворимость веществ
Берется навеска исследуемого вещества, помещается в отмеренное количество растворителя, раствор встряхивается в течение 10 мин.
Все определения проводят при температуре (18-22) градусах по Цельсию.
Для медленно растворимых веществ (время растворения которых более 20 минут) возможно прогревание на водяной бане до 300 Цельсию. После энергичного встряхивания в течение двух минут и охлаждения раствора до (18-22) градусах по Цельсию визуально фиксируют результат. Для медленно растворимых веществ условия растворимости указываются в частных статьях.
Вещество считается растворившимся, если при рассмотрении раствора в проходящем свете в нем не обнаруживаются частицы.
Если неизвестна растворимость вещества, то методика испытания следующая:
Берут 1 г вещества, прибавляют 1 мл растворителя и проводят испытание, как описано выше. Если вещество полностью растворилось, оно считается растворимым очень легко. Если растворение произошло не полностью, то берут 100 мг растертого вещества, добавляют 1 мл растворителя и снова растворяют. Навеска растворилась полностью — делают вывод, что вещество легко растворимо. В случае, если растворение произошло не полностью, в этот раствор добавляют 2 мл растворителя и продолжают испытание. Навеска растворилась — считается, что вещество растворимо. Если растворение прошло не полностью, то в раствор добавляют еще 7 мл растворителя и снова проводят растворение, как описано выше. Если при наблюдении в проходящем свете визуально не наблюдаются частицы, значит растворение прошло. Такое вещество считается умеренно растворимым.
В случае обнаружения нерастворенных частиц навески испытания проводят с 10 мг растертого вещества, добавляя к нему 10 мл растворителя. В том случае, если оно растворилось полностью —вещество считается мало растворимым. Если растворение прошло не полностью, берут 10 мг растертого вещества, прибавляют к нему 100 мл растворителя и снова проводят испытание, как описано в методике. Вещество полностью растворилось — оно очень мало растворимо. Если не растворилось — считается, что вещество практически нерастворимо в этом растворителе.
Для веществ с известной растворимостью проводят испытания по вышеизложенной методике, но только для крайних значений указанного термина растворимости. Например, если вещество растворимо, то 100 мг его не должно раствориться в 1 мл, но полностью растворяется в 3 мл растворителя.
Численное выражение состава растворов
Концентрация раствора — масса растворенного вещества, которая содержится в конкретной массе\объеме растворителя или раствора.
Численное выражение состава растворов находится в массовой доле растворенного вещества, молярная концентрация эквивалента, молярная концентрация, молярная доля, молярная концентрация.
Массовая доля (обозначается как W) называется отношение массы растворенного вещества к массе раствора. То есть W = mраст.в-ва/mраствора на 100%. Если отношение отражение выражение в процентах, тогда это процентная концентрация (C%). Выражают числом граммов растворенного вещества, которое содержится в 100 граммах раствора. К примеру, 20%-раствора соли — раствор, в 100 граммах которого находится 20 граммов соли, а также 80 граммов воды.
Молярная концентрация CM выражена посредством числа молей растворенного вещества, которое содержится в 1 литре раствора. Раствор, который содержит один моль растворенного вещества в одном литре, называют одномолярным (1М), 0,1 моль-децимолярным (0,1 М), 0,01 моль — сантимолярным (0,01 М). CM = n/V = mраст.в-ва(моль/л), где m — масса растворенного вещества, граммы. M является молярной массой растворенного вещества, г/моль. V — объем раствора, л.
Молярная концентрация эквивалента C 1/z выражается в числе моль-эквивалентов растворенного вещества, которые содержатся в 1 литре раствора. здесь z является фактором эквивалентности.
Молярная концентрация Cm выражается при помощи числа молей растворенного вещества, которое содержится в 1 кг (1000 граммов) растворителя. \(Cm=\frac{mраст.в-ва}{M\times{mраств-теля}}=\frac{n}{m}\). Молярная доля вещества в смеси (то есть Ni) является отношением числа молей определенного вещества к сумме числа молей абсолютно всех веществ, которые находятся в смеси или же растворе. \(Ni=\frac{ni}{\sum_ni}.\)
Сумма мольных долей компонентов равняется единице. Титр раствора обозначает массу растворенного вещества, которое содержится в 1 мл раствора T=m/V (г/мл).
Таблицы растворимости солей, кислот и оснований в воде
К нерастворимым веществам относятся:
- Твердые: стекло, сера, золото.
- Жидкие: бензин, растительное масло.
- Газообразные: неон, гелий.
К малорастворимым веществам относятся:
- Твердые: сульфат свинца, алебастр.
- Жидкие: бензол, диэтиловый эфир.
- Газообразные: азот, метан, кислород.
К растворимым веществам относятся:
- Твердые: медный купорос, соль.
- Жидкие: ацетон, спирт.
- Газообразные: аммиак, хлороводород.
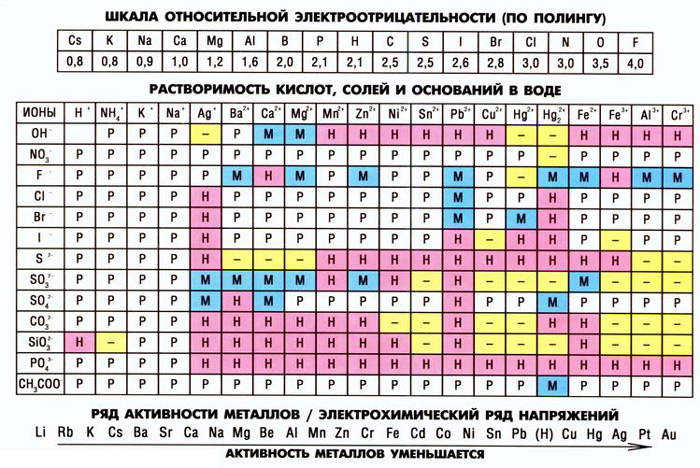
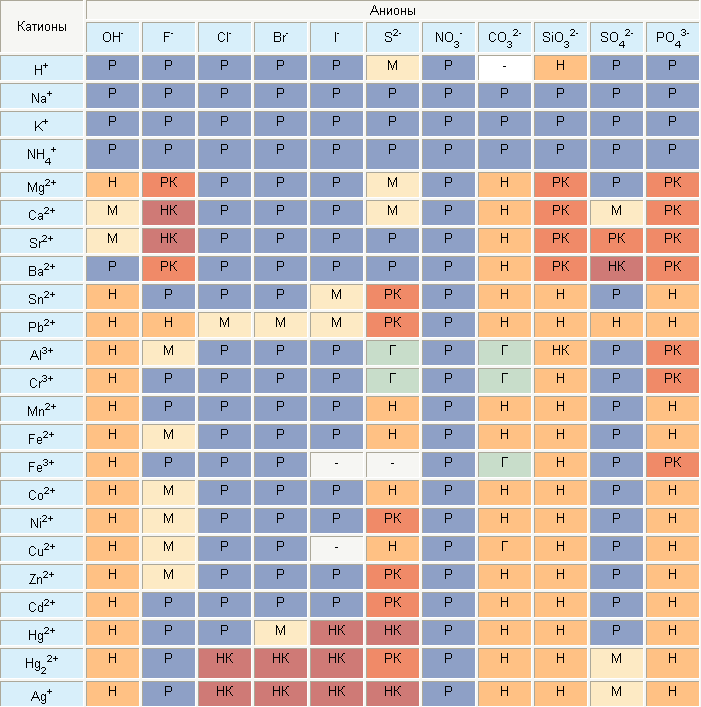
При изучении химии в школе используют упрощенный вариант таблицы растворимости. Для того, чтобы изучать химии на более высоком уровне нужно использовать полную таблицу, в которой приводят полноценные данные о большом числе реакций. В полную таблицу включено намного больше химических соединений и элементов, чем в школьную.
Так выглядит школьная версия таблицы растворимости:
Так выглядит полный (подробный) вариант таблицы растворимости:
Таблицу растворимости обычно используют для того, чтобы проверить все условия протекания реакций, потому что одно из условий протекания реакции служит образование осадка (то есть необратимость реализации реакции), тогда по таблице растворимость возможно проверить образование осадка, таким образом понять, происходит реакция или же нет. В целом, нужно сопоставить ряды.
Пользоваться таблицей растворимости совсем не сложно. Нужно просто посмотреть на то, какое значение располагается на пересечении разных строчек двух частей нужного нам соединения. К примеру, для того, чтобы узнать, будет ли образовываться раствор соли \(MgSo_{4}\) (то есть сульфат магния), нужно найти столбик с \(Mg^{2+}\), а потом опуститься до строчки с \(So_{4}^{2-}\). На строке пересечения будет написано P, то есть данное соединение является растворимым.
Условные обозначения
Для таблицы растворимости справедливы следующие условные обозначения:
- Катионы — частицы и соединения с положительным зарядом.
- Анионы — соединения с отрицательным зарядом.
- Р является веществом, которое хорошо растворяется в воде.
- М является веществом, которое малорастворимо в воде.
- Н является веществом, которое практически не растворяется в воде, однако с легкостью растворяется в разбавленных или слабых кислотах.
- РК является веществом, которое не растворяется в воде, растворение происходит только в сильных неорганических кислотах.
- НК является веществом, которое не растворяется ни в кислотах, ни в воде.
- Г является веществом, которое полностью гидролизуется в случае растворения, не существует в контакте с водой.
- — является веществом, которое не существует.
Решение задач на тему растворимость веществ
Для начала поймем, как решать задачи на растворимость. В целом используется два действенных способа. Рассмотрим их действенность на примере задач из ЕГЭ по химии за 2019 год.
Растворимость безводного карбоната натрия при определенной температуре будет составлять 31, 8 грамма на 100 граммов воды. При данной температуре нужно приготовить насыщенный раствор, при этом добавив нужное количество карбоната натрия к 400 мл воды».
Первый способ решения задачи:
Растворимость не может показать настоящее количество соли или же количество воды. Это будет всего лишь способ выражения концентрации в насыщенных растворах. Это величина, которая показывает, каким образом соотносятся масса воды и масса растворенного вещества (или иного растворенного вещества).
К примеру, в условиях задачи видим, что растворимость карбоната натрия будет 31,8 г на 100 граммов воды. Это означает, что для растворения каждых 31,8 граммов соли нужно добавить 100 граммов воды. Уже исходя из этих данных возможно определить массовую долю растворенного вещества.
Возьмем в пример данный эталонный раствор, в котором содержится 31,8 граммов соли и 100 граммов воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или же 24,13%
Однако в реальном растворе, который сформируется в процессе растворения карбоната натрия в 400 граммах воды, массовая доля соли будет такой же! Со знаниями массы воды и массовой доли соли возможно составить уравнение, а также определить массу соли в настоящем растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Выходит, масса нитрата натрия в реальном растворе будет равна 127,2 г.
Возьмем другой вариант решения задачи.
При использовании того же эталонного раствора возможно составить пропорцию таким образом, чтобы определить массу соли в реальном растворе. На 100 г воды приходится 31,8 г соли (согласно условию)
на 400 г воды будет приходиться х г соли (в настоящем растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Нужно быть внимательным: пропорции возможно составить далеко не для всех величин. Однако соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и практично. Также пропорциональными являются масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Массовая доля вещества в насыщенном растворе равна 24% при определенной температуре. Нужно определить коэффициент растворимости данного вещества при данной температуре.
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра — mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так