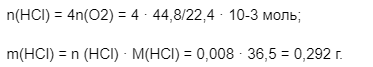Состав и строение атома хлора
Источник: fsd.multiurok.ru
При нормальных условиях хлор является резко пахнущим газом, желто-зеленый цвет которого становится особенно заметным, когда в смеси с воздухом опускается вниз. Обусловлено это тем, что хлор тяжелее воздуха. К органолептическим свойствам также относится его «металлический» вкус. Среди основных химических свойств — высокая химическая активность, заключающаяся в способности образовывать соединения со многими элементами таблицы Менделеева. Объясняется высокая химическая активность особенностями молекулярного и атомного строения.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Особенности строения
В периодической системе Менделеева хлор занимает семнадцатую позицию.
Источник: 24shop.by
Он располагается в седьмой подгруппе, строкой ниже фтора. Эта строка отражает третий период, в правом конце которого расположен элемент с самым большим зарядом ядра. Это и есть хлор — элемент, имеющий также самую значительную в этом периоде степень заполнения электронами электронной оболочки.
Хлор, так же как и остальные представители седьмой подгруппы, является галогеном. Это неметалл.
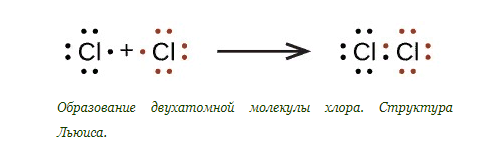
Расположение в таблице Менделеева предполагает особенности молекулярного строения элемента и структуры его молекулы. Так, молекула хлора содержит два атома, поэтому имеет формулу Cl2.
Источник: wika.tutoronline.ru
При этом отмечается, что кристаллическая решетка имеет ромбовидную форму.
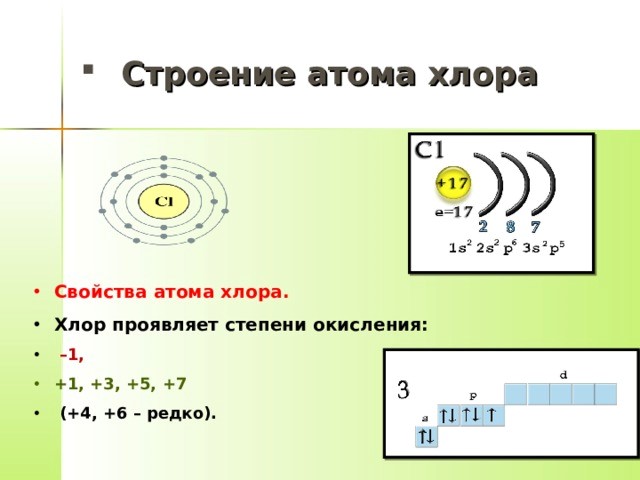
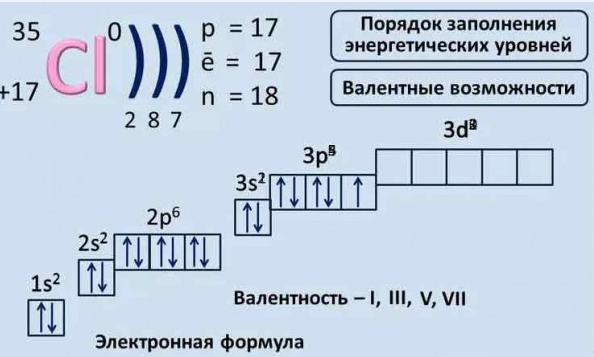
Ядро у атома хлора имеет положительный заряд — +17. Оно состоит из 17 протонов и 18 нейтрально заряженных частиц — нейтронов. Сделать атом нейтральным помогают 17 электронов, отрицательно заряженных. Они вращаются вокруг ядра на внутреннем и внешнем уровнях. Их количество там неодинаково. Если на внутреннем уровне располагаются 10 электронов, то на внешнем их 7.
Электронное строение
Исходя из расположения элемента в третьем периоде, понятно, что атом имеет три оболочки:
- s-орбиталь представляет первую внутреннюю;
- s и p представляют вторую внутреннюю;
- s и p представляют и третья орбиталь — внешнюю.
Расположение электронов характеризуется следующими особенностями:
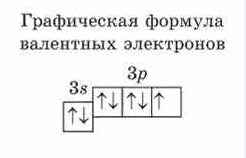
внешний энергетический уровень — два спаренных электрона (3s орбиталь), четыре спаренных (3p орбиталь), один неспаренный (3p орбиталь).
Графическая схема
Как было сказано выше, семб электронов вращаются по соответствующим орбиталям (s и p). При этом, опираясь на расположение хлора, как химического элемента, в третьем периоде, говорит о том, что его формулой является:
Источник: www.soloby.ru
Исходя из этого, можно записать графическую форму атома хлора.
Источник: www.soloby.ru
Исходя из этого, можно записать графическую форму атома хлора.
Если давать общую характеристику атома хлора, то необходимо обратить внимание на то, что он может быть различных валентностей — I, III, V, VII.
Тогда электронные формулы будут иметь следующий вид:
Источник: www.soloby.ru
Электронные особенности строения обуславливают химические свойства хлора и его способность образовывать соединения с другими элементами и химическими веществами.
Формула
В химии каждый элемент имеет формулу, которая отражает его молекулярное строение. Для хлора эта формула Cl2. Она подтверждает наличие в молекуле двух атомов, которые соединены в единое целое по причине наличия неспаренного электрона в каждом атоме.
Свободные электроны обеих атомов соединяются в пару, которая является завершающей из четырех пар. Этот процесс можно выразить схемой:
Источник: spadilo.ru
Когда образуются химические связи (при вступлении в реакции с другими элементами), в них могут участвовать все 5 электронов. Они располагаются на внешнем уровне (3p, 3s). Это объясняет тот факт, что степень окисления хлора в химических реакциях может меняться: от минус единицы до плюс семи.
Особенности атомного и молекулярного строения обуславливают высокую химическую активность хлора (подобно другим галогенам).
Примеры решения задач
Определенное количество хлора было растворено в 5-ти мл обычной воды. Раствор такого состава оставили на свету на некоторое время, по истечении которого было определено, что выделилось 44,8 мл О2. Какова массовая доля HCl, который образовался в ходе реакции?
Решение.
2Cl2+2H2O=4HCl+O2
Исходя из этой реакции, находим следующие величины:
1) Каково количество и масса образованного хлороводорода?
Источник: pandia.ru
2) Вторым действием определяем массу полученного раствора:
Источник: pandia.ru
3) Заключительное действие — нахождение искомой массовой доли:
Источник: pandia.ru
Ответ: Массовая доля образованного хлороводорода равна 0,581%
8 литров хлора было смешано с 12 литрами водорода. Сосуд прочно укупорили и произвели взрыв. Каков объем полученного HCl? Образовался ли еще какой-то газ в ходе реакции? Если да, то в каком объеме?
Решение.
Уравнение химической реакции хлора с водородом следующее: H2+Cl2=2HCl
Отсюда видно, что реакция вступают компоненты в соотношении 1:1. Если по условию соединили 8 л хлора с 12 л водорода, значит на 8 л хлора было израсходовано 8 л водорода. 4л водорода оказалось в избытке, этот объем остался.
22,4 л, составляющие 1 моль водорода, образовали 2 моля хлороводорода (п уравнению реакции). Следовательно , его образовалось 44,8 л. Составляем пропорцию:
22,4 H2 — 44,8 л HCl
8л H2 — х
Х=8*44,8/22,4=16 л
Ответ:
- В результате реакции в сосуде образовалось 16 л хлороводорода.
- В избытке осталось 4 л водорода.
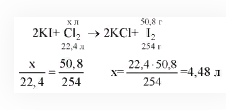
Сколько литров хлора прореагировало с иодидом калия в реакции, в результате которой масса образовавшегося йода составила 508 г?
Решение
Источник: 5terka.com
Ответ: 4,48 л
Необходимо поэтапно составить уравнения химических реакций, которые протекают при следующих процессах:
- Исчезновение запаха хлора при подщелачивании хлорной воды.
- Усиление запаха при последующем добавлении соляной кислоты.
Решение
Cl2+H2O=HCl+HClO
HCl+NaOH=NaCl+H2O
HClO+NaClO+H2O
NaClO+2HCl=NaCl+Cl2+H2O
Вещество хлорид натрия (расплав) было введено в состояние электролиза. При этом выделился газ, который, вступив в реакцию с водородом, образовал неизвестное вещество. Процесс сопровождался резким запахом. Данное вещество было растворено в воде, после чего обработано перманганатом калия. В результате такого действия образовался газ желто-зеленого цвета. После охлаждения он прореагировал с гидроксидом натрия. Какие варианты химических превращений происходили? Написать соответствующие уравнения.
Решение.
- 2NaCl → 2Na+Cl2
- Cl2+H2=2HCl
- 16HCl+2KMnO4=5Cl2+2KCl+2MnCl2+8H2O
- Cl2+2NaOH=NaCl+NaClO+H2O
Что произойдет если на раствор хлороводорода подействовать сильным окислителем, например, KMnO4?
Решение
Уравнение такой реакции имеет следующий вид:
16HCl+2KMnO4=5Cl2+2KCl+2MnCl2+8H2O
Эта реакция может с успехом использоваться для получения хлора в лабораторных условиях.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так