Правило Марковникова в химии
Формулировка правила Марковникова
Впервые это правило сформулировал русский химик Владимир Васильевич Марковников в 1869 году. Правило Марковникова помогает предсказать продукт нуклеофильного присоединения к алкенам. Нуклеофил присоединяется к углероду с наибольшей степенью (первичной, вторичной и т. д.). Выполняется для несимметричных алкенов.
При добавлении протиновой кислоты (HX) к несимметричному алкену кислый водород присоединяется к углероду с большим числом водородных заместителей, а галоидная группа присоединяется к атому углерода с большим числом алкильных заместителей.
Чтобы упростить правило, его можно сформулировать так: Водород присоединяется к углероду с наибольшим количеством гидрогенов, а галоид — к углероду с наименьшим количеством гидрогенов.
Примером реакции, в которой соблюдается правило Марковникова, является присоединение бромистоводородной кислоты (HBr) к пропену.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
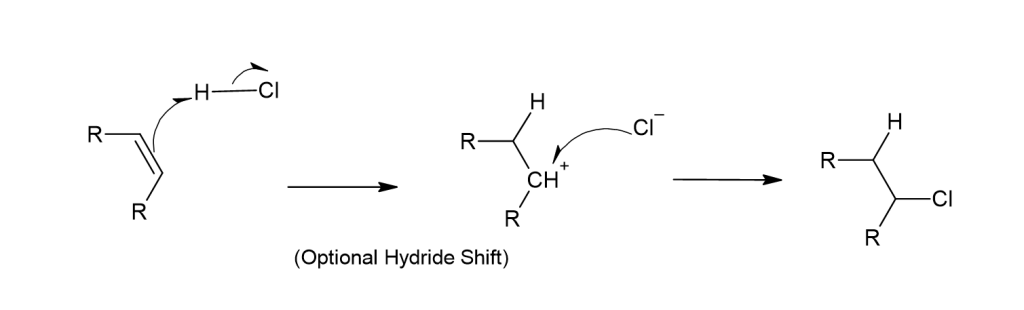
Электрофильное присоединение — это процесс, при котором нуклеофил присоединяется к алкену, предварительно образуя промежуточный карбокатион (например, присоединение галогенов к алкенам).
Эти присоединения имеют общий механизм; например:
- Хлористый водород гетеролитически диссоциирует с образованием протона и хлоридного нуклеофила.
- Позже пи-связь алкена переносит твой водород с образованием карбокатиона. Затем гидридный сдвиг перемещает этот карбокатион к более замещенному углероду (правило Марковникова).
- Дополнительная электронная пара на хлоридном нуклеофиле делится электронами с карбокатионом, образуя ковалентную связь.
Источник: chemistrytalk.org
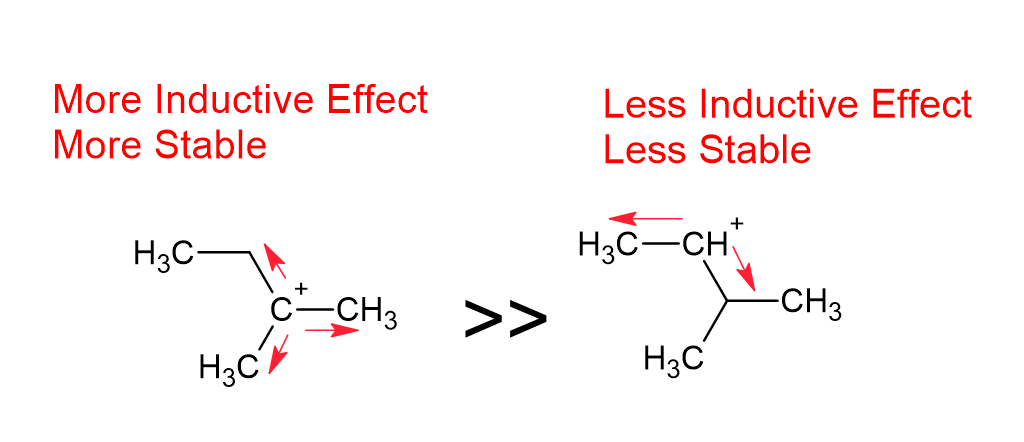
Когда к углеродной цепи присоединяется химический вид, склонный к отдаче или пожертвованию электронов, например алкильная группа, заряд передается по цепи, и этот эффект называется положительным индуктивным эффектом или эффектом +I.
Все элементы в ковалентной молекуле обладают электроотрицательностью. Это означает, что они оттягивают на себя электроны. Когда электроны удаляются от карбокатиона, они делают структуру более стабильной. Поэтому наиболее стабильным карбокатионом будет тот, который испытывает наибольшее притяжение электронов. Таким образом, углеводороды, соединенные с большим количеством углеводородов (т. е. вторичные третичные или четвертичные углеводороды), испытывают большее притяжение электронов и становятся более стабильными. Это и есть положительный индуктивный эффект.
2-метилбутан с показанными диполями индуктивного эффекта
Источник: chemistrytalk.org
Если цепь прямая, то наиболее стабильный карбокатион будет находиться в середине, так как притяжение немного более сбалансировано, чем в любом другом месте цепи. Однако этот эффект уменьшается с увеличением длины цепи. Если два участка идентичны, карбокатион должен быть одинаково устойчив в обоих местах.
Рассмотрим реакцию эфина (C2H4) с хлористым водородом (HCl). Согласно правилу Марковникова, атом водорода из HCl присоединится к атому углерода, имеющему большее число атомов водорода. В результате в качестве продукта образуется хлорэтан (C2H5Cl): CH2=CH2+HCl→CH3CH2Cl.
Другим примером может служить реакция пропена (CH3CH=CH2) с бромистым водородом (HBr). Здесь водород из HBr присоединяется к атому углерода в двойной связи с большим количеством атомов водорода, в результате чего образуется 2-бромпропан (CH3CHBrCH3): CH3CH=CH2+HBr→CH3CHBrCH3.
Механизм правила
- В результате протонирования алкена могут образоваться два типа карбокатионов: первичный и вторичный. Однако вторичный карбокатион гораздо стабильнее, поэтому его образование предпочтительнее образования первичного карбокатиона.
- Теперь нуклеофил галоидного иона атакует карбокатион. В результате реакции образуется алкилгалогенид. Поскольку образование вторичного карбокатиона является предпочтительным, основным продуктом этой реакции будет 2-бромпропан.
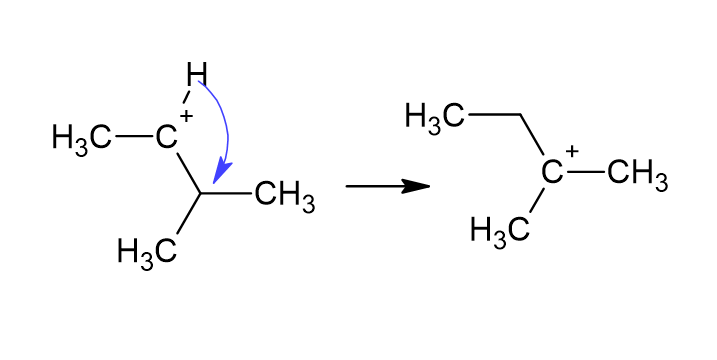
Правило Марковникова объясняет, что в реакции электрофильного присоединения нуклеофил присоединяется к более замещенному углероду, потому что карбокатион (электрофил) там более устойчив. Однако карбокатион не выбирает, где ему образоваться, а перемещается в нужное место после образования. Этот процесс называется гидридным сдвигом.
Гидридный сдвиг — это перегруппировка атома водорода в карбокатионе с целью сделать промежуточную структуру более стабильной. Обычно наблюдается в реакциях перегруппировки.
Источник: chemistrytalk.org
Этот гидридный сдвиг отвечает за региоселективность (вероятность протекания реакции при одном атоме, но не при другом) электрофильного присоединения и может приводить к выходу до 999:1 желаемого продукта к нежелательному при оптимальных условиях для простых молекул. Таким образом, реакции присоединения, противоположные реакциям Марковникова, можно назвать анти-Марковниковскими, исходя из региоселективности реакции.
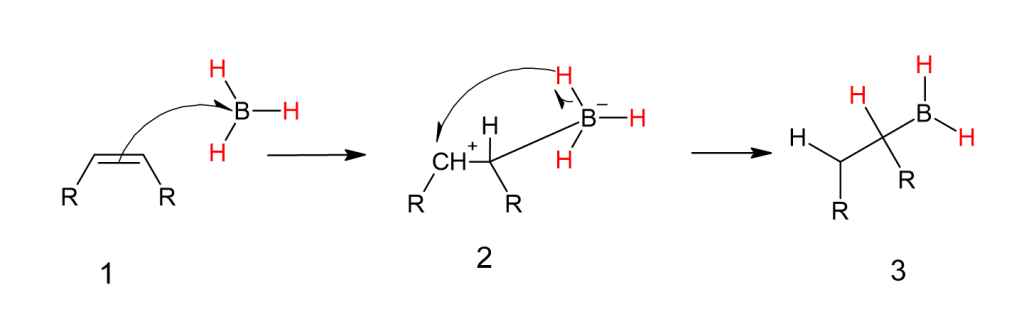
Гидроборирование/окисление алкенов: при обработке алкенов бораном (BH3) в присутствии перекиси водорода или гидроксида натрия в качестве конечного продукта получается спирт. В этой реакции электрофильного присоединения атом бора выступает в качестве электрофила. Эта реакция не подчиняется правилу Марковникова и, следовательно, может быть классифицирована как реакция анти-Марковникова.
Гидратация алкенов: при обработке алкенов некоторыми водными кислотами (обычно серной) в результате реакции электрофильного присоединения в качестве продукта образуется спирт. Региоселективность таких реакций можно предсказать с помощью правила Марковникова. Поэтому эти реакции можно классифицировать как реакции Марковникова. При гидратации алкенов ион H+ действует как электрофил и атакует алкен с образованием промежуточного карбокатиона (протонируется тот промежуточный продукт, который обладает большей стабильностью). Последующая нуклеофильная атака карбокатиона молекулами воды образует оксониевый ион, который депротонируется, чтобы получить требуемый спиртовой продукт.
Когда не работает правило Марковникова
Применимо к электрофильному присоединению, но есть и другие реакции, в которых правило нарушается. Обычно это связано с конкурирующим механизмом, который заставляет карбокатион переходить в менее стабильное положение до присоединения нуклеофила. Существует три основных реакции, в которых это происходит:
1. Пероксиды
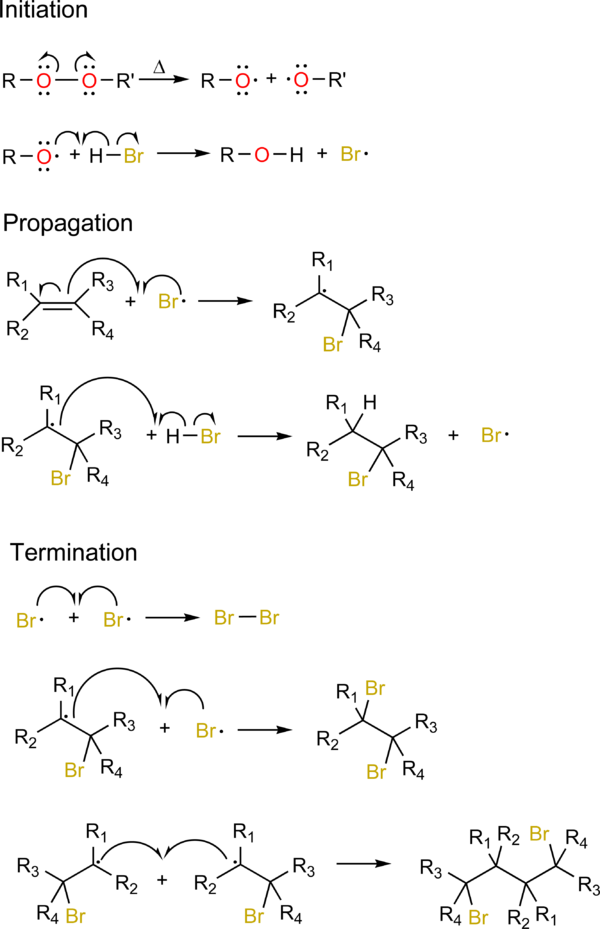
Органические пероксиды вызывают присоединение нуклеофила к менее замещенному углероду. Органические пероксиды хрупки и разрывают связь O-O с образованием двух алкоксидных радикалов. Затем эти радикалы реагируют с гидрогалогеном, образуя галоген-радикал, который вступает в реакцию в соответствии с механизмом присоединения свободных радикалов, показанным ниже.
Источник: chemistrytalk.org
2. Присоединение свободных радикалов
Радикалы еще более стабильны, чем карбокатион, поэтому в ходе реакции радикал преимущественно образуется именно там, вынуждая нуклеофил присоединять другой, менее замещенный углерод.
3. Гидроборирование-окисление
При гидроборировании-окислении индуцированный диполь заставляет боран присоединиться к менее замещенному углероду до того, как произойдет гидридный сдвиг. Когда эта борированная молекула окисляется пероксидом водорода и каким-либо каталитическим основанием, этот боран превращается в спирт на менее замещенном углероде.
Источник: chemistrytalk.org
Значение правила
Многие химические реакции, происходящие в промышленном мире нефтехимии и полимеров, подчиняются правилу Марковникова. Оно используется в многочисленных процедурах с участием алкенов. Очевидная практическая польза этого правила заключается в его способности помочь предсказать основной продукт реакции.
Академические исследования, особенно в области органической химии, в значительной степени опираются на принципы, заложенные в правиле. Исследователи часто используют его для предсказания и объяснения результатов своих экспериментов, особенно при изучении новых методов синтеза органических соединений. При разработке новых синтетических путей для получения желаемых химических веществ ученым необходимо учитывать все возможные исходы последовательности реакций. Правило Марковникова помогает предсказать, где именно галогеноводород присоединит функциональную группу алкена, тем самым определяя последующие шаги в последовательности реакции.
Например, в нефтехимической промышленности в результате процессов крекинга углеводородов образуются различные алкены. Затем эти алкены обрабатываются кислотами, что приводит к реакциям, подчиняющимся правилу Марковникова. Продукты этих реакций часто служат строительными блоками для множества других химических веществ и материалов. Алкилгалогениды используются в различных областях, таких как фармацевтика, агрохимия и хладагенты, а спирты находят применение в производстве растворителей, антифризов, пластификаторов и моющих средств. Полимеры, по сути, окружают нас повсюду - в виде пластмасс, смол, клеев и многого другого.
В фармацевтической промышленности понимание правила Марковникова может иметь решающее значение при синтезе лекарств, где правильное расположение атомов в молекулах лекарств имеет огромное значение. Синтез многих фармацевтических соединений часто включает в себя присоединение галогеноводородов к алкенам. Это очень важно для получения правильных изомеров (с терапевтическим, а не побочным действием).
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так