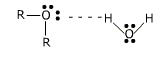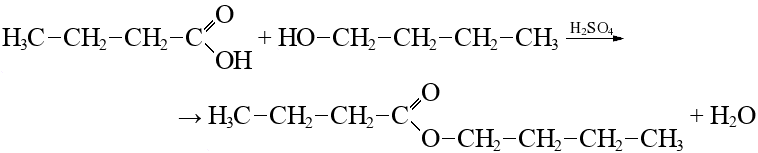Что нужно знать о простых эфирах — основные сведения
Определение. Общая формула простых эфиров
Простые эфиры — это класс органических соединений, которые содержат кислород между двумя алкильными группами.
Эфиры представляют собой класс органических соединений, содержащих эфирную группу — атом кислорода, соединенный с двумя алкильными или арильными группами. Они имеют общую формулу R–O–R', где R и R' представляют алкильные или арильные группы. Эфиры снова можно разделить на две разновидности: если алкильные группы одинаковы с обеих сторон атома кислорода, то это простой или симметричный эфир, тогда как если они разные, эфиры называются смешанными или несимметричными эфирами.
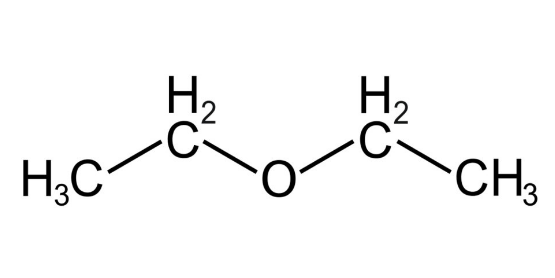
Типичным примером первой группы является растворитель и анестетик под названием «диэтиловый эфир», обычно называемый просто «эфир» (\(СН_3–СН_2–О–СН_2–СН_3\)). Эфиры широко распространены в органической химии и еще более распространены в биохимии, поскольку они являются обычными связующими звеньями в углеводах и лигнине.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Изомерия и номенклатура простых эфиров
Номенклатура эфиров
Общие названия сложных эфиров следуют за названиями алкильных/арильных групп, написанных отдельными словами в алфавитном порядке. В конце добавляется слово эфир. В случае сложных эфиров перед названием алкильной группы добавляется префикс di.
Примеры:
- \(2H_5-O-C_2H_5\) представляет собой диэтиловый эфир;
- \(C_6H_5 - O - C_6H_5\) представляет собой дифениловый эфир;
- \(C_2H_5 - O - C_6H_5\) представляет собой дтилфениловый эфир.
В соответствии с номенклатурой ИЮПАК сложные эфиры рассматриваются как производные углеводородов, в которых атом водорода заменен алкоксигруппой — OR в качестве исходного углеводорода выбрана большая группа (R). Сложные эфиры называются алкоксиалкенами. Большая алкильная группа образует часть родительской цепи, в то время как нижняя алкильная группа образует алкоксирадикал.
Пример: метоксиэтан
Нумерация родительской цепи выполняется таким образом, чтобы атом углерода, связанный с атомом -O, получал наименьшее число.
Классификация эфира
Сложные эфиры известны как простые или симметричные, если две алкильные или арильные группы, присоединенные к атому кислорода, одинаковы.
Пример: \(C_2H_5 - O - C_2H_5\) называется диэтиловым эфиром и представляет собой простой эфир.
Сложные эфиры известны как смешанные или асимметричные, если две группы, присоединенные к атому кислорода, различны.
Пример: \(C_2H_5 - O - CH_3\), называемый этилметиловым эфиром, представляет собой смешанный эфир.
Изомерия в эфире
Алифатические эфиры могут давать три разных типа изомеров:
- Цепная изомерия. Сложные эфиры с одинаковой формулой и имеющие разные скелеты углеродных цепей называются цепными изомерами. Примеры: цепные изомеры сложных эфиров
- Функциональные изомеры. Сложные эфиры изомерны со спиртами. Пример: сложные эфиры изомерны со спиртами, изомерны с этиловым спиртом \(C_2H_5OH\).
- Метамерика. Изомеры с одинаковой молекулярной формулой, но разными алкильными группами (вокруг функциональной группы) называются метамерами. Эфир с формулой \(C_4H_10O\) имеет 3 метамера.
Физические свойства и строение
Молекула эфира обладает суммарным дипольным моментом из-за полярности связей CO. Температура кипения других сравнима с алканами, но намного ниже, чем у спирта с сопоставимой молекулярной массой, несмотря на полярность связи C-O.
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Другие низшие гомологи представляют собой бесцветные, приятно пахнущие летучие жидкости с типичным запахом эфира.
Точки кипения
Связи C - O в эфире полярны, и, следовательно, эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров существенно не влияет на их температуры кипения, которые сопоставимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это происходит потому, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию у них водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы уменьшает тенденцию к образованию Н-связи. Эфиры хорошо растворимы в органических растворителях, таких как спирт, бензол, ацетон и т.д.
Физические свойства сложных эфиров
- Сложные эфиры представляют собой бесцветные жидкости с приятным запахом, в то время как сложные эфиры высших кислот представляют собой бесцветные твердые вещества.
- Низшие эфиры хорошо растворимы в воде. Растворимость сложных эфиров в воде быстро уменьшается с увеличением массы.
- Температуры кипения метиловых и этиловых эфиров ниже, чем у соответствующих исходных кислот.
Строение молекул
Структура молекул простых эфиров
Эфиры представляют собой класс органических соединений, которые содержат sp3-гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R'. эти соединения используются в красителях, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно присоединенных к эфирному кислороду.
Алифатические эфиры
Примеры алифатических эфиров
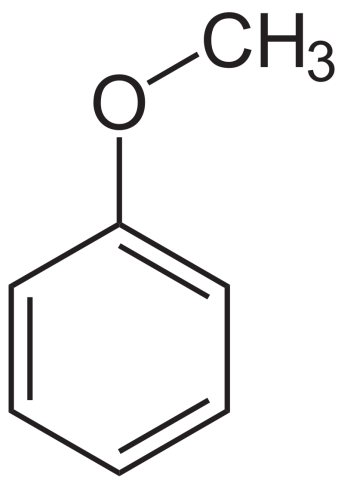
Ароматические эфиры имеют по меньшей мере одно арильное кольцо, непосредственно присоединенное к эфирному кислороду. В ариловых эфирах одиночные пары, образующиеся на кислороде, сопряжены с ароматическим кольцом, что значительно изменяет свойства эфира.
Ариловые эфиры
Пример ароматических эфиров
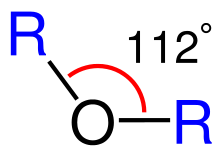
Гибридизация кислорода sp3 дает эфиры примерно той же геометрии, что и спирты и вода. Угол связи R-O-R' близок к тому, что ожидается в тетраэдрической геометрии. Угол связи диметилового эфира составляет 112o, что больше, чем угол связи H-O-H в воде (104,5 o) из-за стерического отталкивания метильных групп.
Угол эфирной связи
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Спектральные свойства
Спектроскопия простых эфиров
Инфракрасная спектроскопия
Кислород образует две связи. Атом кислорода может быть найден между двумя атомами углерода, как в дибутиловом эфире.
Бутиловый эфир масляной кислоты + вода → (H+) → масляная кислота + бутанол-1
Если мы посмотрим на ИК-спектр дибутилового эфира, то увидим:
- существуют обычные режимы растяжения sp3 C-H и изгиба \(CH_2\) при 2900 и 1500 см-1;
- наблюдается сильный пик около 1000 см-1. Этот пик обусловлен вибрацией растяжения C-O.
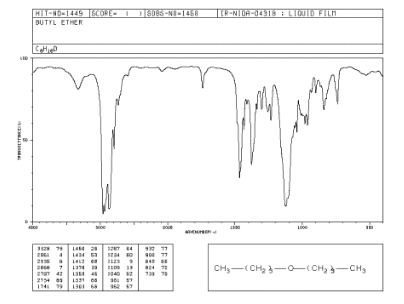
Рисунок ИК. ИК-спектр дибутилового эфира
ЯМР-спектроскопия (ядерного магнитного резонанса)
- Атомы водорода на углероде, прилегающем к эфиру, обнаруживаются в районе 3,4-4,5 частей на миллион.
- Аналогичные пики в эпоксидах смещены в несколько более высокое поле, чем в других эфирах. Содержание водорода в углеродах и эпоксидах составляет от 2,5 до 3,5 промилле.
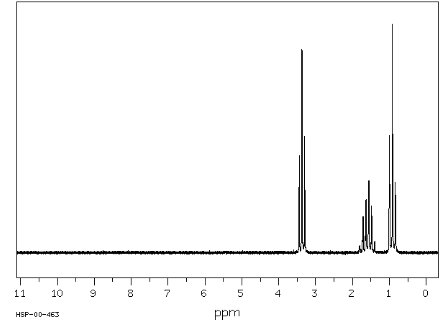
Спектр ЯМР 1Н дипропилового эфира показывает три сигнала с триплетом при 3,37 промилле, присвоенным -\(СН_2\)- рядом с эфиром, и двумя другими сигналами в верхнем поле (1,59 и 0,93 промилле). Протоны, расположенные ближе к электрону, отводящему атом кислорода, находятся дальше по полю, что указывает на некоторое ослабление защиты. Протоны в (A) и (C) каждый связаны с двумя эквивалентными (B) протонами. Итак, каждый из этих сигналов выглядит как триплет. Протоны (B), в свою очередь, соединены с набором из двух и трех эквивалентных протонов, и поэтому вы формально ожидаете четверку тройняшек. Однако, поскольку константы связи очень похожи, сигнал отображается в виде секстета.
Химические свойства
- Разрыв связи C-O. Эфиры, как правило, очень неактивны по своей природе.
- Электрофильное Замещение. Алкоксигруппа в эфире активирует ароматическое кольцо в орто- и пара-положениях для электрофильного замещения.
- Галогенирование эфиров.
- Реакция эфиров Фриделя-Крафтса.
Основные свойства
Эфиры являются относительно инертными соединениями; однако при определенных условиях они подвергаются следующим типам реакций :
- Реакции с участием атома кислорода эфира.
- Реакции, включающие расщепление связи C−O в эфире.
- Реакции с участием алкильной группы эфира.
- Реакции электрофильного замещения в ароматических эфирах.
Эфиры — это бесцветные, сладко пахнущие жидкости, которые очень летучи и легко воспламеняются. Из-за Н-связи и гидрофобных алкильных или арильных групп эфиры плохо растворимы в воде.
Эфиры не имеют внутри себя водородных связей. Поэтому их температуры кипения намного ниже, чем у соответствующих спиртов.
Пары диэтилового эфира вызывают потерю сознания при вдыхании и, таким образом, используются в качестве анестезирующего средства.
Эфиры имеют угол связи C – O – C около 110 °C и, следовательно, дипольные моменты двух C – O. Таким образом, простые эфиры полярны, но имеют слабую полярность (для диэтилового эфира = 1,18).
Простые эфиры обладают более низкой реакционной способностью, чем сложные функциональные группы. На них не воздействуют активные металлы, сильные основания, восстановители и окислители. Химические свойства простых эфиров обусловлены наличием алкильной группы, одинокой пары электронов на атоме кислорода и разрывом связи C – O.
Кислотное расщепление
1. Первым шагом в кислотном расщеплении простых эфиров является протонирование кислорода
Нейтральные эфиры, как правило, устойчивы к нуклеофилам в реакциях замещения — это потому, что уходящая группа должна быть RO- , которая является очень сильным основанием.
По этой причине первым шагом в любом расщеплении эфира является протонирование сильной кислотой. Конъюгированная кислота всегда является лучшей уходящей группой. Протонирование эфира допускает потерю ROH в качестве уходящей группы, которая является значительно более слабым основанием, чем RO- . Это подготовит наш следующий шаг — расщепление одной из связей C–O.
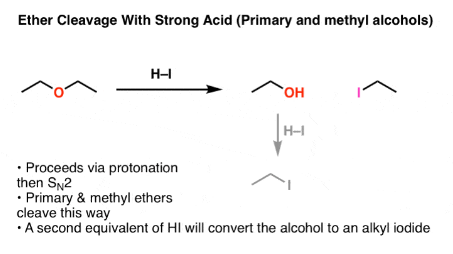
Обычной сильной кислотой, которую выбирают, обычно является иодистоводородная кислота (HI). Он не только мощный (pKa -10), иодидный противоион также играет определенную роль.
2. Для метиловых и первичных эфиров второй стадией расщепления эфира является \(SN_2\)
Что происходит дальше после протонирования? Если мы начнем с первичного эфира, такого как диэтиловый эфир, будет хорошая уходящая группа (ROH) на первичном углероде в присутствии приличного нуклеофила (иодид-иона). Так и должно быть — это идеальные условия для реакции \(SN_2\).
Продукт будет ROH и R-I.
Расщепление эфира диэтиловым эфиром hi дает этанол и йодистый этил этанол образует йодистый этил с избытком hi.
Если присутствует избыток (2 эквивалента или более) HI, этот спирт может быть преобразован в алкилйодид посредством двух последующих стадий (протонирование / \(SN_2\)).
3. Для третичных эфиров второй стадией расщепления эфира является \(SN_1\).
Очевидно, что \(SN_2\) здесь не играет роли, так как третичные атомы углерода слишком затруднены для атаки сзади. Однако третичные карбокатионы относительно стабильны — и ионизация (т.е. потеря уходящей группы) оставляет нас со спиртом (R-OH) и третичным карбокатионом, который затем может быть атакован иодид-ионом с образованием R-I.
Радикальное галогенирование
В отсутствие солнечного света алкильная группа эфира подвергается реакции замещения хлором или бромом с образованием α-галогенированных эфиров.
Однако в присутствии солнечного света все атомы водорода в нем замещаются.
Реакции окисления
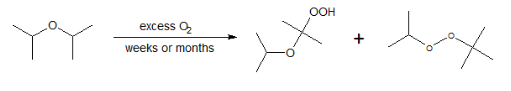
Автоокисление эфиров
Эфиры, подвергающиеся воздействию воздуха, будут самоокисляться до пероксидов, которые потенциально взрывоопасны. Общая реакция показана ниже.
Например, диизопропиловый эфир будет самоокисляться до продуктов, показанных в реакции ниже.
Способы получения простых эфиров
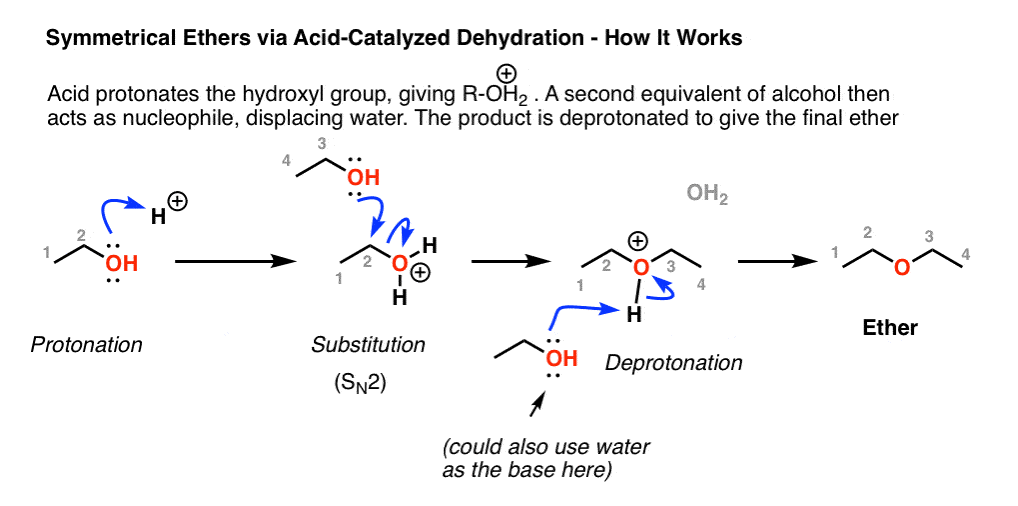
Образование эфира при дегидратации
Катализируемая кислотой дегидратация малых 1º-спиртов представляет собой специализированный промышленный метод получения симметричных эфиров. Эта реакция не может быть использована для получения несимметричных эфиров, поскольку, скорее всего, будет получена смесь продуктов. Кроме того, спирты 2o и 3o нельзя использовать для этой реакции, поскольку они дегидратируются с образованием алкенов по механизму \(E_1\).
\(2CH_3CH_2−OH+H_2SO_4−→---130oCCH_3CH_2−O−CH_2CH_3+H_2O\)
Механизм
На первом этапе механизма реакции один спирт протонируется, чтобы стать хорошей уходящей группой. На второй стадии второй спирт вытесняет воду из протонированного спирта во время реакции \(SN_2\) с получением протонированного эфира. На заключительном этапе этот промежуточный продукт депротонируется с получением симметричного эфира.
Дегидратация спиртов
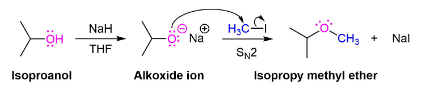
Синтез эфира Уильямсона
Одна важная процедура, известная как синтез эфира Уильямсона, протекает путем реакции \(SN_2\) алкоксидного нуклеофила с первичным алкилгалогенидом или тозилатом. Алкоксиды обычно образуются путем депротонирования спирта с сильным основанием, таким как гидрид натрия (NAH). Простые спирты могут быть использованы в качестве растворителя во время синтеза эфира Уильямсона и с их алкоксидом, полученным путем добавления металлического натрия (Na (s)).
Синтез эфира Уильямсона
Планирование синтеза эфира Уильямсона
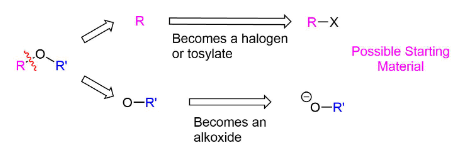
Синтез эфира Уильямсона имеет те же ограничения, что и другие реакции \(SN_2\). Поскольку анионы алкоксида являются сильными основаниями, использование 2o или 3o галогеновых уходящих групп может привести к получению продукта элиминации \(E_2\). При рассмотрении вопроса о синтезе несимметричного эфира возможны две различные комбинации реагентов, и каждая из них должна быть тщательно рассмотрена. В общем, предпочтительным будет путь, в котором используется наименее стерически затрудненный галоген.
Расщепление ключевой связи в молекуле-мишени включает связь C-O. Поскольку несимметричные эфиры имеют две уникальные связи C-O, каждая из них может быть разорвана, чтобы получить уникальный набор реагентов. После расщепления фрагмент с кислородом превратится в алкоксид. Другой фрагмент превратится в галоген или тозилат.
Планирование синтезатора
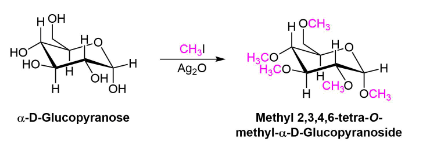
Синтез эфира с использованием оксида серебра
Разновидность синтеза эфира Уильямсона использует оксид серебра (\(Ag_2O\)) вместо сильного основания. Условия этого варианта более мягкие, чем при типичном синтезе Вилламсона, поскольку не требуется сильного основания и образования промежуточного алкоксида. Эта реакция особенно полезна при преобразовании групп -OH на сахаре в простые эфиры.
Пример \( Ag_2O\)
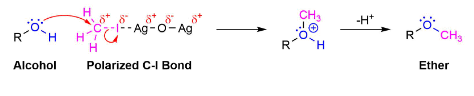
Механизм
Во время этой реакции частично положительно заряженное серебро в \(Ag_2O\) дает меньшую электронную плотность, чем йод в \(CH_3I\). Это соответственно удаляет электронную плотность из соседнего углерода, увеличивая его частичный положительный заряд, что увеличивает его электрофильность. Это позволяет спирту действовать как нуклеофил в последующей реакции \(SN_2\).
Механизм Уильямсона.png
Применение некоторых простых эфиров
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами эфиры, как правило, менее плотны, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно неактивны, и в результате они полезны в качестве растворителей для жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются в качестве инсектицидов, митицидов и фумигантов для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (\(CH_3CH_2―O―CH_2CH_3\)), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, мощный обезболивающий препарат, представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, он в значительной степени был заменен менее легковоспламеняющимися анестетиками, включая закись азота (\(N_2O\)) и галотан (\(CF_3-CHClBr\)).
Этиловый эфир является отличным растворителем для экстракции и для широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве распыляемого топлива и хладагента. Метил-т-бутиловый эфир (МТБЭ) — это присадка к бензину, которая повышает октановое число и уменьшает количество загрязняющих веществ, содержащих оксид азота, в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Химические реакции с участием эфиров
Хотя эфиры относительно инертны по отношению к реакции, они обычно проявляют хорошие свойства растворителя для многих неполярных органических соединений. Эта сильная способность к растворению в сочетании с низкой реакционной способностью делает эфиры хорошими растворителями для проведения реакций.
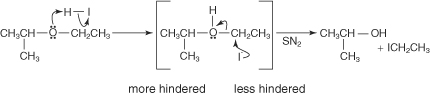
Катализируемое кислотой расщепление, которое происходит, когда иодистоводородная кислота (HI) смешивается с эфирами, является наиболее значительной реакцией, которую испытывают эфиры. Эта реакция протекает по механизму нуклеофильного замещения. Первичные и вторичные алкиловые эфиры реагируют по механизму \(Sn _2\), в то время как третичные, бензиловые и алкиловые эфиры расщепляются по механизму \(Sn _1\). Типичной реакцией \(S N_2\) была бы реакция этилизопропилового эфира с HI. Механизм этой реакции таков:
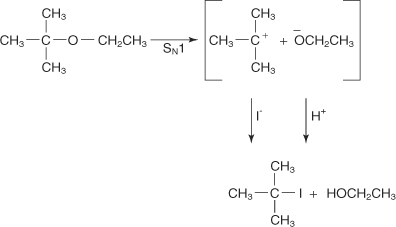
Важно, что для замещения \(S N_2\) алкилгалогенид был получен из менее стерически затрудненной группы. Для реакций типа \(S N_1\) алкилгалогенид образуется из фрагмента исходной молекулы, который образует более стабильный катион. Таким образом, реакция т‐бутилэтилового эфира с HI дает т‐бутилйодид и этиловый спирт. Происходит следующий механизм:
Обратите внимание, что если бы первоначальная ионизация т‐бутилэтилового эфира образовала ион т‐бутоксида и карбокатион этила, это было бы менее стабильное расположение. (Помните, что порядок стабильности карбокатионов равен 3° > 2° > 1°.).
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так