Что нужно знать о периодической таблице Менделеева — основные сведения
Периодическая таблица химических элементов Менделеева — это...
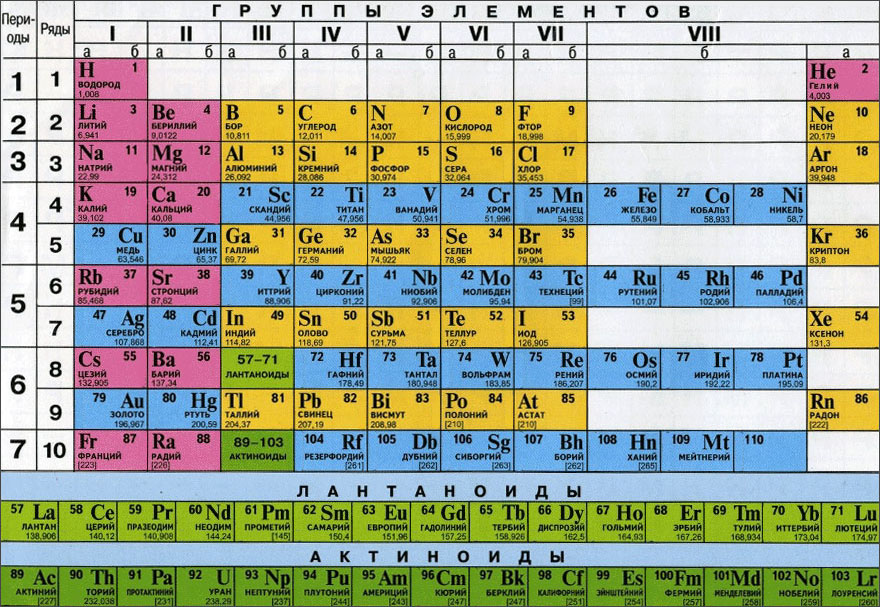
Периодическая таблица химических элементов, часто называемая периодической таблицей Менделеева, упорядочивает все обнаруженные химические элементы по строкам (называемым периодами) и столбцам (называемым группами) в соответствии с увеличением атомного номера.
Ученые используют периодическую таблицу Менделеева, чтобы быстро обратиться к информации об элементе, такой как атомная масса и химический символ. Расположение периодической таблицы также позволяет ученым различать тенденции в свойствах элементов, включая электроотрицательность, энергию ионизации и атомный радиус. Польза таблицы заключается в том, что химик может определить характеристики элемента на основе другого элемента той же группы или периода.
Многие ученые работали над проблемой организации элементов, Дмитрий Менделеев опубликовал свою первую версию периодической таблицы в 1869 году, и его чаще всего считают ее изобретателем. С тех пор периодическая таблица Менделеева эволюционировала, отражая более чем 150-летнее научное развитие и понимание в области химии и физики. Сегодня, имея 118 известных элементов, она широко считается одним из самых значительных достижений в науке.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Химические элементы расположены слева направо и сверху вниз в порядке увеличения атомного номера или числа протонов в ядре атома, что обычно совпадает с увеличением атомной массы.
История открытия
- В 1669 году немецкий торговец и алхимик Хенниг Бранд попытался создать философский камень — предмет, который предположительно мог превращать металлы в чистое золото. Он нагрел остатки кипяченой мочи, и жидкость выпала и загорелась. Это считается первым открытием фосфора.
- В 1680 году Роберт Бойль также открыл фосфор.
- В 1809 году было открыто по меньшей мере 47 элементов, и ученые начали видеть закономерности в их характеристиках.
- В 1863 году химик Джон Ньюлендс разделил открытые тогда 56 элементов на 11 групп, основываясь на характеристиках.
- В 1869 году русский химик Дмитрий Менделеев начал разработку периодической таблицы Менделеева, упорядочив химические элементы по атомной массе. Он предсказал открытие других элементов и оставил для них свободные места в своей периодической таблице.
- В 1886 году французский физик Антуан Бекерель впервые открыл радиоактивность. Студент Томсона из Новой Зеландии Эрнест Резерфорд назвал три типа излучения: альфа, бета и гамма-лучи. Мария и Пьер Кюри начали работать над излучением урана и тория, а впоследствии открыли радий и полоний. Они обнаружили, что бета-частицы заряжены отрицательно.
- В 1894 году сэр Уильям Рамзи и лорд Рэлей открыли благородные газы, которые были добавлены в периодическую таблицу как группа 0.
- В 1897 году английский физик Дж. Дж. Томсон впервые открыл электроны являются небольшими отрицательно заряженные частицы в атоме. Джон Таунсенд и Роберт Милликен определили их точный заряд и массу.
- В 1900 году Беккерель обнаружил, что электроны и бета-частицы, идентифицированные Кюри, — это одно и то же.
- В 1903 году Резерфорд объявил, что радиоактивность вызывается распадом атомов.
- В 1911 году Резерфорд и физик Ганс Гейгер обнаружили, что электроны вращаются вокруг ядра атома.
- В 1913 году Бор понял, что электроны движутся вокруг ядра с дискретной энергией, называемой орбиталями. Излучение испускается во время перемещения с одной орбиты на другую.
- В 1914 году Резерфорд впервые идентифицировал протоны в атомном ядре. Он также впервые преобразовал атом N в атом O. Английский физик Генри Мозли предоставил атомные номера, основанные на количестве электронов в атоме, а не на его массе.
- В 1932 году Джеймс Чедвик впервые открыл нейтроны, тогда же были идентифицированы изотопы. Это была основа для периодической таблицы Менделеева. Кокрофт и Уолтон впервые расщепили атом, бомбардируя литий в ускорителе частиц, превратив его в два ядра гелия.
- В 1945 году Гленн Сиборг идентифицировал лантаноиды и актиноиды (атомный номер 92), которые обычно помещаются ниже периодической таблицы.
В 1869 году русский химик Дмитрий Менделеев создал структуру, которая стала современной периодической таблицей, оставив пробелы для элементов, которые еще предстояло открыть. Расставляя элементы в соответствии с их атомным весом, если он обнаруживал, что они не вписываются в группу, он переставлял их. Менделеев предсказал свойства некоторых неоткрытых элементов и дал им такие названия, как «экаалюминий» для элемента со свойствами, подобными алюминию. Позже экаалюминий был обнаружен как галлий. Некоторые расхождения остались; положение некоторых элементов, таких как йод и теллур, объяснить не удалось.
Периодическая таблица Менделеева 1869 года на русском языке с названием, которое переводится как «Эксперимент с системой элементов ... основанный на их атомных весах и химическом сходстве».
Общее понимание того, как элементы связаны друг с другом и почему они проявляют свои особые химические и физические свойства, приходило медленно. Между 1868 и 1870 годами, в процессе написания своей книги «Принципы химии», Менделеев создал таблицу или диаграмму, в которой перечислены известные элементы в порядке возрастания атомных весов. Когда он разложил таблицу по горизонтальным строкам, стала очевидна закономерность — но только в том случае, если он оставил в таблице пробелы. Если бы он это сделал, элементы с аналогичными химическими свойствами появлялись через определенное количество времени, периодически в вертикальных столбцах таблицы.
Менделеев был достаточно смел, чтобы предположить, что будут найдены новые, еще не открытые элементы, которые заполнят пустые места. Он даже зашел так далеко, что предсказал свойства недостающих элементов. Хотя многие ученые встретили первую таблицу Менделеева со скептицизмом, ее прогностическая ценность вскоре стала очевидной. Открытие галлия в 1875 году, скандия в 1879 году и германия в 1886 году подтвердило идею, лежащую в основе таблицы Менделеева. Каждый из новых элементов проявлял свойства, соответствующие тем, которые предсказал Менделеев, основываясь на его понимании того, что элементы в одной и той же колонке обладают схожими химическими свойствами. Три новых элемента были открыты соответственно французским, скандинавским и немецким учеными, каждый из которых назвал элемент в честь своей страны или региона. (Галлия по латыни означает Францию.) Открытие нового элемента стало предметом национальной гордости - редкий вид науки, о котором люди могли читать в газетах и о котором упоминали даже политики.
Утверждение о новом элементе теперь означало не только определение его уникальных химических свойств, но и определение атомного веса атома, чтобы элемент мог быть помещен в нужное место в периодической таблице. Для радиоактивных атомов это было трудной задачей. Сначала эти атомы выделялись лишь в микроскопических количествах. Самый простой способ идентифицировать их заключался вовсе не в их химических свойствах, а в их излучении. До тех пор, пока радиоактивные атомы не могли быть отсортированы с помощью традиционной химии, некоторые ученые неохотно называли их новыми элементами.
Структура Периодической системы элементов
Большинство символов похожи на название элементов, но есть определенные символы объектов с латинскими корнями. Его примером является серебро, описанное Ag, которое происходит от его латинского названия «Argentum». Одним из таких примеров может быть буква «Fe» и символ, используемый для обозначения металла и может быть связан с латинским словом «железо» — «Феррум».
Как устроена периодическая таблица Менделеева?
Водород разделяет свой единственный валентный электрон с одним из валентных электронов кислорода; когда два атома водорода образуют эти ковалентные связи с одним атомом кислорода, в результате получается H2O или вода.
Водород разделяет свой единственный валентный электрон с одним из валентных электронов кислорода; когда два атома водорода образуют эти ковалентные связи с одним атомом кислорода, в результате получается H2O или вода.
Периодическая таблица Менделеева упорядочена по атомному весу и валентным электронам. Эти переменные позволили Менделееву поместить каждый элемент в определенную строку (называемую точкой) и столбец (называемый группой). Таблица состоит из семи строк и 18 столбцов. Каждый элемент в одном ряду имеет такое же количество атомных орбиталей (пространств, в которых существуют электроны), как и остальные в этом ряду или периоде. Это означает, что все элементы третьего периода — натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон — имеют три атомные орбитали, на которых находятся их электроны.
Между тем, столбец или группа означает количество электронов во внешней оболочке атома; они называются валентными электронами, и это электроны, которые могут химически связываться с валентными электронами других элементов. Валентные электроны могут быть либо разделены с другим элементом, типом ковалентной связи, либо обменены в виде ионной связи, согласно Lumen Learning.
Например, все элементы во втором столбце имеют два валентных электрона; в третьем столбце они имеют три валентных электрона. Есть некоторые исключения из этого правила в переходных элементах, которые заполняют более короткие столбцы в центре периодической таблицы. Эти переходные элементы.
Можно выбрать селен, атомный номер которого равен 34, что означает, что в нейтральном атоме селена всего 34 электрона. Этот неметалл находится в периоде 4, группа 6А. Это означает, что селен удерживает свои электроны на четырех атомных орбиталях и имеет шесть валентных электронов, или шесть электронов на самой внешней орбите. Вы также можете выяснить, сколько электронов находится на его первой, второй и третьей орбиталях: Первая орбиталь может содержать максимум два электрона, в то время как вторая имеет четыре суборбитали и, таким образом, может содержать в общей сложности восемь электронов. По данным факультета химии и биохимии Университета штата Флорида, третья оболочка атома, состоящая из девяти суборбиталей, может содержать максимум 18 электронов. Это означает, что селен имеет 2, 8, 18 и 6 электронов на своей первой, второй, третьей и четвертой атомной орбитали соответственно.
Группы
Столбцы или группы в периодической таблице представляют атомные элементы, имеющие одинаковое количество валентных электронов, или те электроны, которые находятся во внешней орбитальной оболочке.
В качестве примера, все элементы группы 8A (или VIIIA) имеют полный набор из восьми электронов на орбитали с наивысшей энергией, согласно химику Уильяму Роушу на его веб-странице в Университете штата Мичиган. Элементы, занимающие один и тот же столбец периодической таблицы (называемые группой), имеют идентичные конфигурации валентных электронов и, следовательно, ведут себя химически аналогичным образом. Например, все элементы группы 18 являются инертными газами, что означает, что они не вступают в реакцию ни с какими другими элементами.
Существует несколько способов группировки элементов, но обычно они делятся на металлы, полуметаллы (металлоиды) и неметаллы. Есть более конкретные группы, такие как переходные металлы, редкоземельные элементы, щелочные металлы, щелочноземельные, галогены и благородные газы.
Группы в Периодической таблице элементов
Группа 1: Щелочные металлы
Щелочные металлы являются мягкими, пластичными и хорошими проводниками электричества и тепла. В эту группу входят элементы Литий, натрий, Калий, рубидий, цезий и франций. Щелочные металлы очень реакционноспособны. По сравнению с другими элементами они имеют низкую температуру плавления и кипения.
Группа 2: Щелочноземельные металлы
Вторая группа элементов в периодической таблице Менделеева - щелочноземельные металлы. Эти элементы содержатся в земной коре и представляют собой мягкие и серебристые металлы. Они могут проводить тепло и электричество и могут быть изготовлены в виде листов. Некоторыми элементами этой группы являются бериллий, кальций и магний.
Группа 3: Группа 12: Переходные Металлы
Элементы из группы с 3 по 12 называются переходными металлами. Они включают семейства элементов скандий, титан, Ванадий, Хром, Марганец, Железо, Кобальт, Никель, Медь и цинк. Переходные металлы твердые и плотные, являются хорошими проводниками тепла и электричества и легко поддаются изгибу. Золото, Железо и медь являются важными такими элементами. Периодическая таблица расположена в группах элементов со схожими характеристиками.
Группа 13: Группа Бора
Группа бора названа в честь ведущего элемента бора. Они являются хорошими проводниками, но редко встречаются в природе. Алюминий является исключением в этой группе, поскольку он встречается в изобилии.
Группа 14: Углеродная группа
Углеродная группа состоит из углерода, кремния, Германия, Олова, свинца и флеровия. Все элементы встречаются в природе довольно широко, за исключением флеровия. Элементы этой группы и их соединения обычно токсичны.
Группа 15: Пниктогены
Пниктогены состоят из азота (N), за которым следуют фосфор (представленный как P), мышьяк (As), Сурьма (Sb), Висмут (Bi) и, наконец, Московий (Mc). В то время как азот и фосфор встречаются в природе, остальные отсутствуют, поскольку московий является синтетическим элементом, производимым только в лабораториях.
Группа 16: Халькогены
Халькогены содержат элементы Кислород, Серу, Селен, Теллур и радиоактивный элемент Полоний. Ливерморий - синтетический элемент, входящий в эту группу. В то время как кислород и фосфор в изобилии встречаются в природе, селен и теллур — нет. Полоний обнаруживается только в следовых количествах из-за радиоактивного распада, а ливерморий производится только в лабораториях.
Группа 17: Галогены
Галогены состоят из фтора, хлора, брома, йода, астатина и синтетического элемента Теннессина. Это неметаллы, которые являются плохими проводниками с низкими температурами плавления и кипения. Группа галогенов также является единственной группой, в которой при комнатной температуре в элементах можно увидеть все три состояния вещества.
Группа 18: Благородные газы
Благородные газы состоят из гелия, Неона, Аргона, Криптона, ксенона, Радона и синтетического газа Оганессона. Они составляют около 0,96% атмосферы. Эти газы находят различные применения, такие как освещение, сварка и освоение космоса, хотя по своей природе они крайне неактивны и бесцветны.
Периоды
Горизонтальные строки периодической таблицы называются периодами, где каждый номер периода указывает количество орбиталей для элементов в этом ряду, согласно данным Лос-Аламосской национальной лаборатории. (Атомы имеют протоны и нейтроны в своем ядре, и вокруг них их электроны расположены на орбиталях, где атомная орбиталь — это математический термин, который описывает местоположение электрона, а также его волнообразное поведение.)
В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами. Период 1 содержит только два элемента (водород и гелий), в то время как периоды 2 и 3 содержат 8 элементов. Периоды 4 и 5 состоят из 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, отделенные от остальной части таблицы, принадлежат этим периодам. Они выдвигаются для того, чтобы сама таблица легче помещалась на одной странице.
Блоки
В соответствии с современным периодическим законом, основанным на атомном номере и расположении электронов валентной оболочки элементов, различные типы металлов и неметаллов в химии организованы так, чтобы образовать s, p, d и f-блок в периодической таблице.
Элементы s-образного блока
Название f-блочный элемент в периодической таблице дано из-за расположения электронов, валентный электрон входит в ns-орбиталь и постепенно заполняется в соответствии с правилами конфигурации. Группа-1 (водород, литий, натрий, калий, рубидий, цезий и франций) и группа-2 (бериллий, магний, кальций, стронций, барий и радий) принадлежат к этим классам с электронной конфигурацией валентной оболочки, ns1→2, где n = основное квантовое число, или количество периодов.
Элементы p-блока
P-блок в периодической таблице упорядочен постепенно заполняющейся p-орбиталью в электронной структуре валентной оболочки, но гелий является исключением с расположением электронов 1s2. Группа-3, 4, 5, 6, 7, и благородные газы относятся к элементам p-блока. Начиная со второго периода p-блока элементы, такие как бор, углерод, азот, кислород, фтор и аргон, заполнили s-орбитали электронной конфигурацией валентной оболочки, 2s2 2p1→6, где n = количество периодов.
Элементы d-блока и f-блока
Название d-блок (переходный ряд) или f-блок (внутренний переходный ряд) в периодической таблице используется из-за наличия постепенно заполняемых d или f-орбиталей в электронной структуре валентной оболочки. Семейство переходов или внутренних переходов образует ионную химическую связь с металлами (s-блок) и ковалентную связь с неметаллами (p-блок). Таким образом, элементы 3d-блока, такие как скандий, титан, ванадий, хром, железо, кобальт, никель, медь и цинк, размещаются в середине таблицы между s и p-блоками с электронной конфигурацией валентной оболочки, 4s0→2 3d1-10. f-блок в периодической таблице разделен на две серии, такие как 4f или лантаноиды, а 5f или актиноиды содержат много недостающих элементов, обнаруженных или синтезированных в результате ядерной реакции радиоактивных изотопов.
Чтение Периодической таблицы Менделеева
Периодическая таблица содержит огромное количество информации:
Атомный номер: Количество протонов в ядре атома называется атомным номером этого элемента. Количество протонов определяет, какой это элемент, а также определяет химическое поведение элемента. Например, атомы углерода всегда имеют шесть протонов, атомы водорода всегда имеют один, а атомы кислорода всегда имеют восемь. Разные версии одного и того же элемента, называемые изотопами, могут иметь разное количество нейтронов; также элемент может получать или терять электроны, чтобы стать заряженным, и в этом случае они называются ионами.
Атомный символ: Атомный символ (или символ элемента) — это аббревиатура, выбранная для обозначения элемента («C» для углерода, «Na» для натрия и «Y» для иттрия и т.д.). Эти символы используются на международном уровне и иногда являются неожиданными.
Атомная масса: Стандартный атомный вес элемента — это средняя масса элемента, выраженная в единицах атомной массы (amu). Несмотря на то, что каждый атом имеет примерно целое число единиц атомной массы, вы заметите, что атомная масса в периодической таблице является десятичной; это потому, что число представляет собой средневзвешенное значение различных встречающихся в природе изотопов элемента, основанное на их изобилии.
Изотоп — это разновидность элемента с другим числом нейтронов в ядре.
Например, как рассчитать атомную массу углерода, состоящего из двух изотопов:
Умножить содержание изотопа на его атомную массу:
Углерод-12: 0,9889 х 12,0000 = 11,8668;
Углерод-13: 0,0111 х 13,0034 = 0,1443;
Затем добавить результаты:
11,8668 + 0,1443 = 12,0111 = атомный вес углерода.
Атомная масса для элементов 93-118: Для созданных в лаборатории трансурановых элементов (элементов за пределами урана, имеющих атомный номер 92) "естественного" изобилия не существует, отметила Лос-Аламосская национальная лаборатория (LANL). Для этих элементов атомный вес самого долгоживущего изотопа указан в периодической таблице, согласно Международному союзу чистой и прикладной химии (ИЮПАК) - мировому авторитету в области химической номенклатуры и терминологии. Эти атомные веса следует считать предварительными, поскольку в будущем, согласно LANL, может быть получен новый изотоп с более длительным периодом полураспада (сколько времени требуется для разложения 50% этого элемента).
Сверхтяжелые элементы или элементы с атомными номерами выше 104 также подпадают под эту неестественную категорию. Чем больше ядро атома — которое увеличивается с увеличением числа протонов внутри — тем, как правило, более нестабилен этот его элемент. Как таковые, эти элементы большого размера мимолетны, длятся всего миллисекунды, прежде чем распадаться на более легкие элементы, согласно ИЮПАК. Например, сверхтяжелые элементы 113, 115, 117 и 118 были проверены ИЮПАК в декабре 2015 года, завершив седьмую строку или период в таблице. Несколько разных лабораторий произвели сверхтяжелые элементы. Атомные номера, временные названия и официальные названия являются:
113: унунтрий (Uut), нихоний (Nh);
115: ununpentium (Uup), moscovium (Mc);
117: унунсептиум (Uus), теннессин (Ts);
118: унуноктиум (Uuo), оганессон (Og).
Как изменяются свойства элементов в Периодической таблице
Свойства элемента иногда классифицируются либо как химические, либо как физические. Химические свойства обычно наблюдаются в ходе химической реакции, в то время как физические свойства наблюдаются при исследовании образца чистого элемента. Химические свойства элемента обусловлены распределением электронов вокруг ядра атома, особенно внешних, или валентных, электронов; именно эти электроны участвуют в химических реакциях. Химическая реакция не влияет на атомное ядро; поэтому атомный номер остается неизменным в химической реакции.
Некоторые свойства элемента можно наблюдать только в совокупности атомов или молекул этого элемента. Эти свойства включают цвет, плотность, температуру плавления, температуру кипения, а также тепловую и электрическую проводимость. В то время как некоторые из этих свойств обусловлены главным образом электронной структурой элемента, другие более тесно связаны со свойствами ядра, например, массовым числом.
Элементы иногда группируются в соответствии с их свойствами. Одна из основных классификаций элементов — металлы, неметаллы и металлоиды. Элементы с очень похожими химическими свойствами часто называют семействами; некоторые семейства элементов включают галогены, инертные газы и щелочные металлы. В периодической таблице элементы расположены в порядке возрастания атомного веса таким образом, что элементы в любом столбце обладают схожими свойствами.
Тенденции периодической таблицы
Понимание периодического изменения энергии ионизации, сродства к электрону, электроотрицательности, свойств кислот и оснований, числа окисления в окислительно-восстановительной реакции химических элементов являются очень важными характеристиками для любого обсуждения или информации в химии или науке. При изучении химии мы суммируем физические и химические свойства по группам и периодам.
Когда мы двигаемся вниз в группе, размер и электроположительный характер атомов увеличиваются. Энергия ионизации обычно уменьшается, но во многих случаях увеличивается из-за экранирования электронов или эффективных ядерных зарядов. У нижнего элемента кристаллических твердых металлов, таких как серебро (Ag), золото (Au), кадмий (Cd) и ртуть (Hg), энергия ионизации увеличивается. Электроотрицательность и сродство к электрону обычно уменьшаются, но иногда наблюдаются некоторые исключения. Тенденция сродства к электрону химического элемента второго ряда периодической таблицы обычно ниже, чем у третьего ряда.
Периодическая таблица с электронной конфигурацией
Пара элементов расположена по диагонали друг к другу в таблице периодов, чтобы описать простое соотношение или химические свойства, такие как электрическая поляризация содержимого в химии. Диагональная пара, такая как бериллий и алюминий, имеет аналогичное соотношение изменения / размера, поскольку размер увеличивается с меньшим периодом, в то время как заряд увеличивается вправо, но это правило не может работать полностью для всех элементов периодической таблицы.
Интересные факты в периодической таблице Менделеева, объясняющие общую связь между электронной структурой и периодическим размещением, предназначением химических элементов в краткой форме. Например, орбиталь 1s может иметь только два электрона, следовательно, период один содержит только два элемента. Период-VI включает 6s, 4f, 5d и 6p орбитали в электронной структуре валентной оболочки с общим количеством (2 + 14 + 10 + 6) = 32 элемента от цезия до радона. Упрощенная научная формула в химии используется для вычисления количества химических элементов в каждом периоде семейств периодической таблицы Менделеева.
Значение таблицы Менделеева
Периодическая таблица элементов находится в классах, коридорах кампусов и библиотеках, но предназначена она в первую очередь для ученых, которые могут использовать таблицу для анализа реакционной способности элементов, прогнозирования химических реакций, понимания тенденций в периодических свойствах различных элементов и размышлений о свойствах тех, которые еще предстоит открыть.
Значение таблицы постепенно становилось ясным, но не ее смысл. Ученые вскоре поняли, что расположение элементов в таблице в порядке атомного веса было проблематичным. Атомный вес газа аргона, который нелегко вступает в реакцию с другими элементами, поместил бы его в ту же группу, что и химически очень активные твердые вещества литий и натрий. В 1913 году британский физик Генри Мозли подтвердил более ранние предположения о том, что химические свойства элемента лишь приблизительно связаны с его атомным весом (сейчас известно, что он примерно равен числу протонов плюс нейтронов в ядре). Что действительно имеет значение, так это атомный номер элемента — количество протонов, которые несет его атом, которое Мозли мог определить с помощью рентгеновских лучей. С тех пор элементы были расположены в периодической таблице в соответствии с их атомными номерами. Структура таблицы отражает особое расположение электронов в каждом типе атома. Только с развитием квантовой механики в 1920-х годах ученые выяснили, как электроны упорядочиваются, чтобы придать элементу его свойства.
Как сегодня используется Периодическая таблица Менделеева
Зная, что определенные элементы, которые собраны вместе на столе, обладают определенными характеристиками и поведением, ученые могут определить, какие из них лучше всего подходят для определенных отраслей и процессов. Например, инженеры используют различные комбинации элементов в группах III и V таблицы для создания новых полупроводниковых сплавов, таких как нитрид галлия (GaN) и нитрид индия (INN), согласно Национальному институту стандартов и технологий (NIST).
В общем, химики и другие ученые могут использовать таблицу, чтобы предсказать, как определенные элементы будут реагировать друг с другом. Щелочные металлы, например, находятся в первом столбце или группе таблицы и, как правило, имеют один валентный электрон и поэтому несут заряд +1. Этот заряд означает, что они «энергично реагируют с водой и легко соединяются с неметаллами», — написала химик Энн Мари Хелменстайн. Магний, который входит в ту же группу, что и кальций, становится полезным в составе сплавов для костных имплантатов, сказал NIST. Поскольку эти сплавы поддаются биологическому разложению, они служат строительными лесами, а затем исчезают после того, как на конструкциях вырастает естественная кость.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так