Кислород — что это за вещество
Что такое кислород
Кислород представляет собой химический элемент шестнадцатой группы, второго периода периодической системы, с атомным номером 8.
Кислород относят к группе неметаллов с выраженной химической активностью. Легкий элемент обладает самой маленькой массой при рассмотрении в рамках группы халькогенов. Играя роль простого вещества, кислород имеет газообразное агрегатное состояние при условиях, соответствующих нормальным значениям. Вещество не обладает цветом, вкусом или запахом.
Кислородная молекула включает в свой состав пару кислородных атомов. В результате формулу записывают, как \(O_{2}\). По этой причине нередко элемент называют дикислородом. В жидком агрегатном состоянии кислород приобретает светло-голубую окраску. Твердый кислород кристаллизован и обладает светло-синей окраской.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Науке известны и другие аллотропные формы кислорода. К таковым относят озон, который представляет собой газообразной вещество голубой окраски с характерным специфическим запахом. Молекула озона включает в свой состав три кислородных атома, поэтому формулу вещества записывают, как \(O_{3}\).
История открытия
По официальной версии, открытие кислорода принадлежит химику из Англии Джозефу Пристли. Опыт был выполнен 1 августа 1774 года и заключался в разложении оксида ртути, помещенного в герметичный резервуар. Ученый направлял на содержимое сосуда солнечные лучи, используя достаточно мощную линзу. Химическую формулу этой реакции можно записать таким образом:
\(2HgO\rightarrow2Hg + O_{2}\uparrow\)
Стоит отметить, что Пристли не удалось сразу выявить образование в результате реакции нового простого вещества. По мнению ученого, опытным путем была получена какая-то часть воздуха в газообразном агрегатном состоянии, названная «дефлогистированным воздухом». Собственным открытием Пристли поделился с известным химиком из Франции Антуаном Лавуазье, которому через год в 1775 году удалось прийти к заключению о вхождении кислорода в состав воздуха, кислот, а также прочих многих веществ.
Несколько раньше в 1771 году опыты с получением кислорода ставил шведский химик Карл Шееле. Ученый прокаливал селитру и серную кислоту для последующего разложения полученного соединения в виде оксида азота. Образованный газ получил название «огненный воздух». Открытие было описано в 1777 году в опубликованном научном труде. Аналогично Шееле рассказал о проделанном опыте Лавуазье.
Важнейшей стадией экспериментального процесса, направленного, как оказалось в будущем, на открытие элемента кислорода, считают труды химика из Франции Пьера Байена. Публикации ученого описывают опыт, смысл которого состоит в окислении ртути и дальнейшем разложении полученного оксида. По итогам исследовательской деятельности выяснить природу образованного газообразного вещества удалось А. Лавуазье.
С помощью практических наработок авторства Пристли и Шееле ученый Лавуазье систематизировал информацию, проделал уникальную работу, представляющую огромную научную ценность. Таким образом, была опровергнута флогистонная теория, а наука химия получила активное развитие, избавившись от тормозившего ее суждения.
Эксперименты Лавуазье служили полным опровержением опыта по сжиганию разных веществ и теории флогистона. В публикации научных изысканий были представлены указания на вес сожженных элементов. Масса золы больше по сравнению с исходным весом элемента. На основании этого Лавуазье заключил, что процесс горения сопровождается химической реакцией, то есть окислением, вещества. По этой причине масса начального материала возрастает. Данное утверждение противоречило теории флогистона и ставило под сомнение ее корректность.
Исходя из представленных выше фактов, можно прийти к выводу о равноценном научном вкладе в открытие кислорода ученых Пристли, Шееле, Лавуазье.
Откуда произошло название
В начале XIX века элемент носил название «кислотвор». Термин «кислород» в русском языке возник, благодаря в определенной степени М. В. Ломоносову. Ученый ввел данное понятие в обиход в комплексе с прочими неологизмами. В результате слово «кислород» приобрело смысл аналога понятия «оксиген», которое было предложено А. Лавуазье. В переводе оно обозначает «порождающий кислоту». Наименование объясняется исходным значением «кислота». Этот термин ранее служил в качестве обозначение веществ, которые в современной науке называют «оксидами».
Физические свойства
В нормальных условиях кислород имеет газообразное агрегатное состояние, не обладает какой-либо окраской, вкусом или цветом. В таком состоянии один литр вещества весит 1,429 г. Таким образом, масса кислорода больше по сравнению с аналогичными показателями воздуха. Вещество отличается низкой степенью растворимости в водной среде и спирте. Однако кислород хорошо растворяется в серебре, если оно находится в расплавленном виде, и в перфторированных углеводородах.
Расстояние, на которое удалены атомы в молекуле кислорода, составляет 0,12074 нм. Вещество относят к группе парамагнетиков. Если кислород приобретает жидкое агрегатное состояние, то его можно притянуть магнитом. В процессе нагрева кислорода в газообразном состоянии протекает обратимая реакция диссоциации на атомы. Запишем разные концентрации диссоциированных атомов в полученной смеси:
- +2000 °C — 0,03 %;
- +2600 °C — 1 %;
- +4000 °C — 59 %;
- +6000 °C — 99,5 %.
Температура кипения жидкого кислорода составляет −182,98 °C с условием, что давление равно 101,325 кПа. В таких исходных данных вещество имеет вид жидкости с бледно-голубой окраской. Значение критической температуры в случае кислорода составляет 154,58 К (-118,57 °C), а критическое давление равно 4,882 МПа.
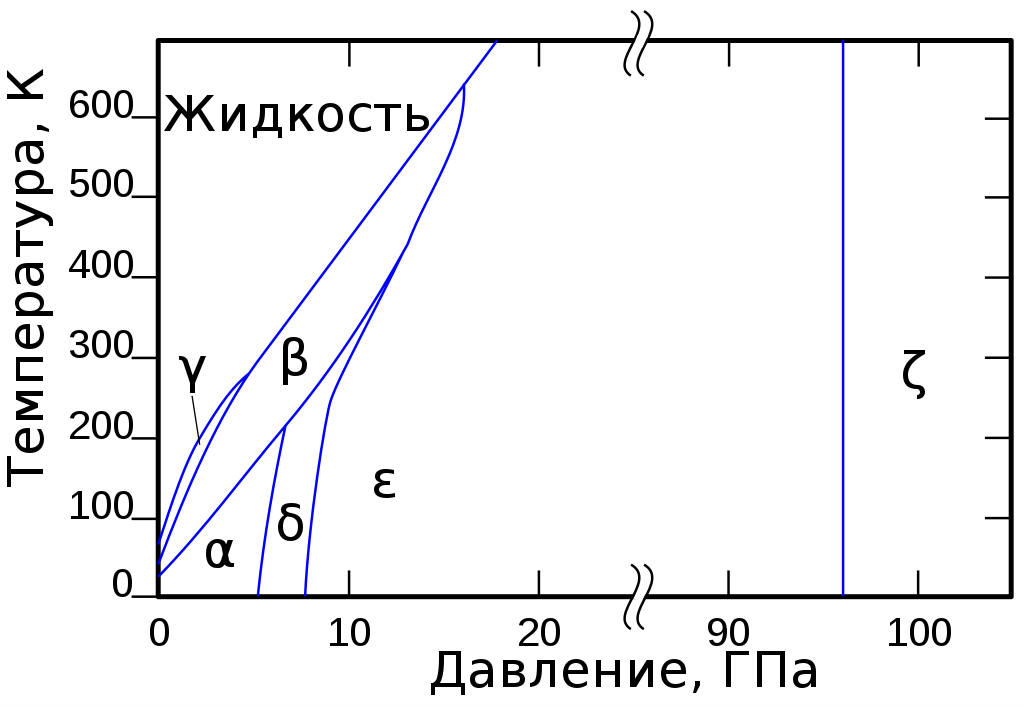
Рассмотрим, как выглядит фазовая диаграмма \(O_{2}\) :
Источник: ru.wikipedia.org
В твердом агрегатном состоянии кислород имеет вид кристаллов с синей окраской. Температура плавления вещества в данном случае составляет 218,35 °C. Принято выделять шесть кристаллических фазовых состояний кислорода. Три фазы можно наблюдать, когда давление равно 1 атм.:
- \(\alpha—O_{2}\)с характерной температурой менее 23,65 K. Вещество обладает кристаллической структурой ярко-синей окраски.
- \(\beta—O_{2}\), температурный режим соответствует интервалу от 23,65 до 43,65 K. Кристаллы с ромбоэдрической решеткой имеют бледно-синюю окраску. Если повысить давление, то вещество окрасится в розовый цвет.
- \(\gamma—O_{2}\), при температуре от 43,65 до 54,21 K. Кристаллическое вещество с бледно-синей окраской характеризуется кубической симметрией.
Следующую тройку фаз кислорода можно наблюдать при повышенных значениях давления:
- \(\sigma—O2\), с температурой от 20 до 240 K и давлением от 6 до 8 ГПа. Кристаллическая структура обладает оранжевой окраской;
- \(\epsilon\)—фаза, в состав которой включены молекулы O4, либо O8. Данная фаза наблюдается, когда давление соответствует интервалу от 10 до 96 ГПа. Кристаллическое вещество имеет окраску от темно-красного до черного и характеризуется моноклинной сингонией;
- \(\zeta—On\) при давлении выше, чем 96 ГПа. Вещество в металлическом состоянии с присущим ему металлическим блеском. Если температура низкая, вероятен переход в сверхпроводящее состояние.
Химически свойства
Кислород обладает сильными окислительными свойствами. Это неметалл с максимальной активностью после фтора. С его помощью формируются бинарные соединения, называемые оксидами, со всеми элементами, за исключением следующих:
- гелий;
- неон;
- аргон;
- фтор.
При химическом взаимодействии кислорода и фтора формируется фторид кислорода. Это объясняется большей электроотрицательностью фтора по сравнению с кислородом.
Самой распространенной степенью окисления кислорода является вторая. Наиболее часто в результате химического взаимодействия кислорода с веществами, то есть окисления, выделяется тепловая энергия. Скорость течения процесса увеличивается при нагреве. Запишем несколько типичных реакций, которые можно наблюдать в условиях комнатной температуры:
\(4Li + O_{2} \rightarrow 2Li_{2}O\)
\(2Sr + O_{2} \rightarrow 2SrO\)
Кислород обладает способностью окислять такие соединения, в состав которых входят элементы, не имеющие максимальную степень окисления:
\(2NO + O_{2} \rightarrow 2NO_{2}\uparrow\)
Органические соединения в большинстве своем окисляются кислородом в процессе реакции горения:
\(2C_{6}H_{6} + 15O_{2} \rightarrow 12CO_{2} + 6H_{2}O\)
\(CH_{3}CH_{2}OH + 3O_{2} \rightarrow 2CO_{2} + 3H_{2}O\)
Если создать определенные условия, то можно реализовать процесс мягкого окисления органического соединения:
\(CH_{3}CH_{2}OH + O_{2} \rightarrow CH_{3}COOH + H_{2}O\)
Химическое взаимодействие кислорода при нормальных условиях, при повышении температуры и/или при наличии катализаторов возможно непосредственно с каждым из простых веществ. В качестве исключений следует рассматривать Au и инертные газообразные вещества, в том числе, He, Ne, Ar, Kr, Xe, Rn. Кислород вступает в реакции с галогенами, когда на вещества воздействует электричество или ультрафиолетовое излучение.
Косвенным методом реализовано получение оксидов золота и тяжелых инертных газообразных веществ таких, как Xe и Rn. В каждом из соединений, состоящих из пары элементов, одним из которых является кислород, он выполняет функцию окислителя. Исключением служит соединение с фтором. Кислород способен формировать пероксиды, для которых характерна степень окисления кислородного атома, формально равная −1.
Пример реакции получения пероксидов в процессе сгорания щелочных металлов в кислородной среде:
\(Na + O_{2} \rightarrow Na_{2}O_{2}\)
В качестве примера реакции поглощения определенными видами оксидов кислорода можно привести следующее уравнение:
\(2BaO + O_{2} \rightarrow 2BaO_{2}\)
Согласно теоретическим знаниям о горении, сформулированным А. Н. Бахом и К. О. Энглером, окисление протекает в два этапа. Промежуточным продуктом химической реакции является пероксидное соединение. Его выделяют, к примеру, в процессе понижения температуры пламени горящего водорода с помощью льда. В результате можно наблюдать формирование пероксида водорода, наряду с водой:
\(H_{2} + O_{2} \rightarrow H_{2} O_{2}\)
Реакция пероксидов и кислорода в условиях нагрева и высокого давления:
\(Na_{2}O_{2} + O_{2} \rightarrow 2NaO_{2}\)
Процесс химического взаимодействия калия K, рубидия Rb и цезия Cs с кислородом сопровождается формированием надпероксидов:
\(K + O_{2}\rightarrow KO_{2}\)
Реакция озона и гидроксидов щелочных металлов:
\(3KOH + 3O_{3} \rightarrow 2KO_{3} + KOH \cdot H_{2}O + 2O_{2}\uparrow\)
Пример проявления восстановительных свойств кислорода:
\(PtF_{6} + O_{2} \rightarrow O_{2}PtF_{6}\)
Получение дифторида кислорода \(OF_{2}\) путем пропускания фтора через щелочной раствор в разбавленном состоянии:
\(2F_{2} + 2NaOH \rightarrow 2NaF + H_{2}O + OF_{2}\uparrow\)
Получение монофторида кислорода, называемого диоксидифторидом, из смеси фторида с кислородом в тлеющем разряде при температурном режиме, равном −196 °C:
\(F_{2} + O_{2} \rightarrow O_{2}F_{2}\)
Кислород способен поддерживать следующие процессы:
- дыхание;
- горение;
- гниение.
В свободной форме кислород представлен парой аллотропных модификаций, то есть, \(O_{2}\) и \(O_{3}\). Великими научными деятелями Пьер Кюри и Мария Склодовская-Кюри в 1899 году было установлено, что в случае воздействия на \(O_{2}\) ионизирующего излучения осуществляется его переход в \(O_{3}\).
Получение
Одним из методов синтеза кислорода является перегонка жидкой воздушной смеси. Промышленная технология получения данного вещества носит название криогенная ректификация. Кроме того, массовое производство кислорода основано на эксплуатации специальных установок.
Принцип действия такого оборудования заключается в использовании мембранной технологии и адсорбции. Полученный материал поставляют в лаборатории. В качестве транспортировочной тары используют стальные баллоны. Вещество в них находится под давлением, значение которого составляет примерно 15 Мпа.
Далее рассмотрим технологию разложения соединений, в состав которых входит кислород. В процессе химических реакций элемент извлекают с целью дальнейшего использования. К примеру, уравнение химической реакции, сопровождающейся нагревом перманганата калия \(KMnO_{2}\):
\(2KMnO_{4} \rightarrow K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow\)
Получение кислорода с помощью каталитического разложения пероксида водорода \(H_{2}O_{2}\) при наличии в смеси оксида марганца (IV):
\(2H_{2}O_{2} \rightarrow [MnO_{2}] 2H_{2}O + O_{2}\uparrow\)
Химическая реакция каталитического разложения хлората калия, то есть бертолетовой соли \(KClO_{2}\), которая сопровождается высвобождением кислорода:
\(2KClO_{3} \rightarrow 2KCl + 3O_{2}\uparrow\)
Впервые кислород удалось получить в результате разложения оксида ртути(II) (при t = 100 °C):
\(2HgO \rightarrow [100{°}C] 2Hg + O_{2}\uparrow\)
Электролиз водных растворов относят к лабораторным методам синтеза кислорода. В процессе используют растворы на основе воды с кислотами, щелочами, определенными видами солей, к примеру, сульфатами и нитратами щелочных металлов. Запишем в качестве примера уравнение химической реакции:
\(2H_{2}O \rightarrow [e^-] 2H_{2}\uparrow + O_{2}\uparrow\)
Следующий способ выработки кислорода используют на подводных лодках и орбитальных станциях. Метод заключается в химическом взаимодействии пероксида натрия и углекислого газа, который является продуктом дыхания человека:
\(2Na_{2}O_{2} + 2CO_{2} \rightarrow 2Na_{2}CO_{3} + O_{2}\uparrow\)
С целью сбалансировать воздушную среду к полученному кислороду добавляют надпероксид калия. Для того чтобы снизить вес в некоторых случаях в условиях космического корабля используют пероксид лития.
Нахождение в природе
Кислород характеризуется максимальным распространением в твердой оболочке нашей планеты. Он занимает примерно 47% от веса земной коры. Кислород представлен разными соединениями, по большей части, силикатами. Элемент в связанном состоянии содержится в пресной и морской воде. Его доля составляет 85,82%, если рассчитывать по массе. Свыше 1,5 тысяч соединений твердой оболочки планеты включают в свой состав кислород.
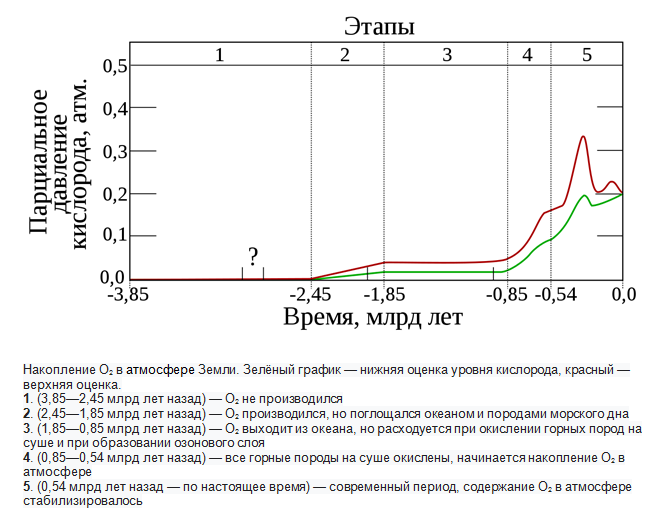
Рассмотрим график, демонстрирующий накопление кислородных запасов в земной атмосфере в зависимости от временного периода:
Источник: ru.wikipedia.org
Кислород в свободной форме присутствует в атмосфере нашей планеты:
- 20,95 %, если рассчитывать по объему;
- 23,10 %, исходя из массы, что соответствует примерно 1,015 т.
Стоит отметить, что много лет назад, а именно 3,5 млрд. в эпоху архея, кислород было бы сложно найти в атмосферном воздухе. Появление элемента в несвязанном виде в крупных объемах характерно для периода палеопротерозоя, что соответствует временному промежутку 3—2,3 млрд лет назад. Причина данного явления заключалась в смене компонентного атмосферного состава в мировых масштабах. Эта историческая стадия преобразования планеты Земля носит название «кислородная катастрофа».
В течение первого миллиарда лет почти полностью происходило поглощение кислорода такими элементами, как железо, которое присутствовало в океанах в растворенном виде. В результате образовались крупные объемы джеспилита, залегающего на дне. Во временной период, отмеченный 3—2,7 млрд лет назад, началось выделение кислорода в атмосферные массы. С течением времени, а именно, 1,7 млрд лет назад, концентрация кислорода в атмосферной оболочке оставляло 10% от значений, характерных для современных.
По причине высокой концентрации элемента в разных состояниях, то есть свободном или в форме соединений, в океанических водах и воздухе анаэробные живые организмы в большинстве своем вымерли. С другой стороны, кислород используется в процессах дыхания на клеточном уровне. Благодаря этому свойству, аэробные организмы получили возможность увеличить выработку АТФ по сравнению с анаэробными. Таким образом, аэробные организмы стали доминировать.
В первые временные периоды кембрия, то есть 540 млн. лет назад, с точки зрения объемной доли концентрация кислорода варьировалась в пределах от 15% до 30%. По окончанию каменноугольного периода, что происходило примерно 300 млн. лет назад, содержание элемента приблизилось к максимальной отметке в 35%. Этим, вероятнее всего, объясняется укрупнение насекомых и земноводных в рассматриваемый период.
Превалирующая доля кислорода на нашей планете является результатом жизнедеятельности фитопланктона, средой обитания которого являются воды Мирового океана. Примерно 60% элемента от количества, потребляемого живыми организмами, идет на реализацию процессов гниения и разложения. Около 80% кислорода, вырабатываемого лесными массивами, необходимо, чтобы перерабатывалась растительность.
Человечество в процессе осуществления деятельности, не оказывает сильного влияния на повышение объемов атмосферного кислорода в свободном состоянии. Учитывая актуальные значения скорости фотосинтеза, потребуется примерно 2 тыс. лет на восстановление всего атмосферного кислорода. Элемент является одним из составных компонентов превалирующего числа веществ органической природы происхождения и присутствует в каждой живой клетке.
Применение
В промышленном секторе кислород стали использовать массово с середины XX века. Триггером развития этого направления послужил турбодетандер. Изобретенное в это время устройство предназначено для того, чтобы сжижать и разделять воздух в жидком агрегатном состоянии.
В металлургической отрасли кислород необходим для реализации технологии выпуска стали и обработки штейнов. Метод является конвертерным. С целью значительно повысить эффективность потребления топливных ресурсов в оборудовании производят смену воздуха на кислородно-воздушную смесь.
Кислород незаменим для сварки и резки металлических заготовок, деталей и конструкций. Газ закачивают в специальные резервуары, которые называют баллонами. Емкости имеют голубую окраску, что является стандартизированной маркировкой.
Элемент используют для производства ракетного топлива. В этом случае кислород играет роль окислителя и применяется в жидком агрегатном состоянии. Кроме того, с этой же целью используют соединения, обогащенные кислородом, в том числе, пероксид водорода и азотная кислота. Если смешать жидкий кислород и жидкий озон, то получится один из наиболее эффективных окислителей для ракетного топлива.
Медицинский кислород хранят и транспортируют в емкостях из металла под давлением. Цвет баллонов голубой. В зависимости от объема резервуары могут быть от 1,2 до 10 л. Давление во внутренней области таких баллонов составляет максимум 15 Мпа. Целевое назначение газа:
- насыщение смесей для дыхания в оборудовании, предназначенном для наркоза;
- оказание помощи при затруднении дыхательных процессов;
- купирование приступов бронхиальной астмы;
- лечение гипоксии в разных случаях;
- терапия при декомпрессионной болезни;
- лечебные процедуры для пациентов с заболеваниями пищеварительной системы;
- приготовление кислородных коктейлей, обладающих терапевтическим эффектом.
На промышленных предприятиях, специализирующихся на выпуске пищевой продукции, используют специальные добавки с кислородом, промаркированные, как E948. Кроме того, в этой области промышленности кислород используют в качестве пропеллента и газообразного вещества для упаковки продуктов.
В химической промышленности элемент играет роль реактива-окислителя. Вещество необходимо для реализации разнообразных синтезов. В качестве примера можно привести окислительные реакции для трансформации углеводородов в кислородсодержащие соединения в виде спиртов, альдегидов, кислот, а также диоксида серы в триоксид серы, аммиака в оксиды азота, что используется для получения азотной кислоты.
Применение кислорода в сельскохозяйственном секторе:
- производство кислородных коктейлей;
- прирост веса у животных;
- насыщение водных ресурсов в рыбоводстве.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так