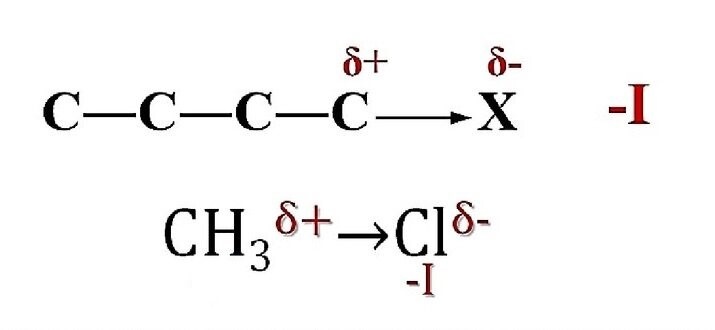Индуктивный эффект в органической химии
Индуктивный эффект — это
Индуктивный эффект в химии — это изменение электронной плотности в молекуле, вызванное электроноотнимающими или электронодонорными группами в других частях молекулы, в результате чего возникает постоянный диполь в связи между двумя электронами.
Принцип действия
Источник: dzen.ru
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
В ковалентной σ-связи между двумя атомами с разной электроотрицательностью более электроотрицательный атом притягивает к себе связующую пару, потому что у него гораздо большее сродство к электронам. Из-за этого притяжения более электроотрицательные атомы создают частичный отрицательный заряд (σ -), а другие — частичный положительный заряд (σ+). Этот процесс приводит к неравному разделению электрона связи.
Ковалентная связь становится поляризованной, образуя постоянный диполь в соединении. Индуктивный эффект относится к непрерывному состоянию поляризации связи. Символ индуктивного эффекта — (->-) со стрелкой. Стрелка всегда направлена в сторону более электроотрицательного атома.
Индуктивный эффект передается от одного атома к другому в виде длинной цепочки соединений. Но эффект постепенно ослабевает и становится несущественным. Например, предположим, что клемма атома углерода соединена с электроотрицательным атомом галогена (электроноотрицательная группа). В этом случае положительный заряд передается по всей углеродной цепи.
Аналогично индуктивному эффекту, когда электронодонорная группа или атом присоединяется к терминальному атому углерода углеродной цепи, отрицательный заряд передается по углеродной цепи.
Некоторые особенности индуктивного эффекта
Возникает из-за различий в электроотрицательности двух атомов, которые связаны сигма (σ) связями.
- Индуктивный эффект переносится на сигма-связи, на пи ( π)-связи он не распространяется.
- Если удалиться от групп, вызывающих этот эффект, то амплитуда индуктивного эффекта также уменьшится.
- Индуктивный эффект длится долгое время, он также способен образовывать в молекуле устойчивый диполь.
- Индуктивные эффекты влияют на вещества как химически, так и физически.
- Этот эффект слаб и иногда подавляется другими электронными процессами, такими как резонанс, гиперконъюгация и т.д.
Индуктивный эффект влияет на некоторые важные свойства органических соединений. Некоторые из них:
- Определение кислотной силы алифатических карбоновых кислот.
- Оценка стабильности алкилкарбокатионов, карбанионов и свободных углеродных радикалов также зависит от индуктивных эффектов.
- Он влияет на дипольный момент и длину связи.
- Индуктивный эффект влияет на прочность органических оснований.
Положительный
+I Эффект
Когда атом или группа присоединяет электроны для образования связи и приобретает частичный положительный заряд, он относится к группе +I. В этом случае эффект называется положительным индуктивным эффектом или +I-эффектом.
Пример групп +I:
- O -, - COO -, -CR3, -CHR2, -CH2R, -CH3, -D.
Отрицательный
-I эффект
Группа -I образуется, когда атом или группа притягивает к себе электроны связи и накапливает частичный отрицательный заряд. Этот эффект также называют индуктивным эффектом оттягивания электронов или эффектом -I.
Примеры -I-групп:
-NO2, - SO2R, -CN, -SO2Ar, -COOH, -F, - Cl, - Br, - I, -OAr, -COOR, -OR, -COR, -SH, -SR, -OH, -Ar, - CH = CR2.
Порядок индуктивного эффекта
Для индуктивных эффектов - I и + I можно выделить следующие группы в порядке убывания силы:
Порядок индуктивных эффектов для групп +I:
- O -> - COO -> -CR3> -CHR2 > -CH2R > -CH3 > -D.
Порядок индуктивных эффектов для групп -I:
-NR3+ > -SR2+ > -NH3+ > -NO3 > - SO2R > -CN > -SO2Ar > -COOH > -F > - Cl > - Br > - I > -OAr > -COOR > -OR > -COR > -SH > -SR > -OH > -Ar > - CH = CR2.
Примеры
Тело
Примером явления, зависящего от расстояния, является эффект -I, при котором заряд химической связи изменяет ориентацию окружающих связей в той же или других молекулах, что приводит к постоянному состоянию поляризации в молекуле. Когда атомы двух разных элементов соединяются вместе, образуя связь, электронная плотность связи распределяется неравномерно. Когда в связи образуются электронные облака, они стремятся выровняться в направлении более электроотрицательного элемента связи.
Индуктивный эффект имеет место в молекулах воды. Химические связи внутри молекулы воды более положительно заряжены вблизи атомов водорода, а вблизи атомов кислорода они более отрицательно заряжены. В результате молекулы воды обладают полярностью. Однако другие факторы могут быстро нейтрализовать индуктивный эффект из-за малой величины индуцированного заряда и того факта, что он действует только на коротких расстояниях.
Алкилгалогениды
Галогеноалканы — это другое название алкилгалогенидов. При работе с немагнитными материалами индуктивные эффекты, такие как положительные фазовые углы при измерениях импеданса, часто вызывали недоумение ученых и инженеров. Некоторые из этих индуктивных эффектов могут быть вызваны емкостной связью между измеряемым материалом и землей, когда измерения основаны на методе автобалансирного моста, а измеряемый материал представляет собой громоздкий образец. Емкостная связь между телом человека и землей учитывается при разработке модели с четырьмя электродами для биоимпедансных измерений на теле человека. Импедансометры на основе автобалансировочного моста не могут измерять импеданс заземления; чтобы обойти это ограничение, в данной работе мы предложим метод оценки паразитной емкости на землю с помощью этих приборов.
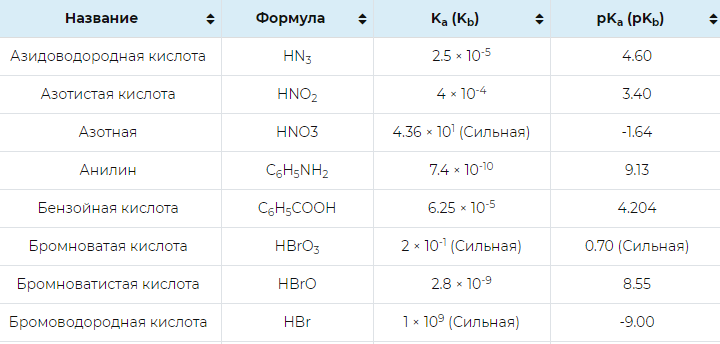
Константа ионизации
Источник: chemhelp.ru
Константа ионизации (K) определяет равновесие между ионами и неионизированными молекулами в растворе или жидкости. То есть это отношение продуктов к реактивам, возведенное в стехиометрическую степень. В равновесной реакции скорости прямой и обратной реакции равны. Это константа равновесия для диссоциации в кислотно-основных процессах. Концентрация, например, может меняться. Потому что концентрация показывает, сколько вещества было удалено.
Соотношения концентраций можно соединить, чтобы получить константу. Таким образом, кислоты больше, а ионов меньше. Одним из следствий этого индуктивного эффекта является ослабление связей между гетероатомами (O, N, S...) и атомами водорода. Уменьшая электронную плотность в свободном дублете, электроноакцепторная группа увеличивает кислотность связи O-H в кислоте (тем самым ослабляя связь O-H), но уменьшает основность атома азота в амине (тем самым увеличивая основность атома азота).
Степень диссоциации ионов определяет pH вещества. K — это метод, позволяющий связать концентрацию с другими расчетами, такими как pH. Например, снижение содержания кислотных загрязнителей в воде предотвращает коррозию системы. Таким образом, многочисленные внешние процедуры очистки могут уменьшить кислотность воды. Любой дисбаланс в уравнении может вызвать коррозию.
Алкилгалогениды
Алкилгалогениды — это соединения, в которых атомы галогена в алкилгалогениде заменили один или несколько атомов водорода в алкане (фтор, хлор, бром или йод).
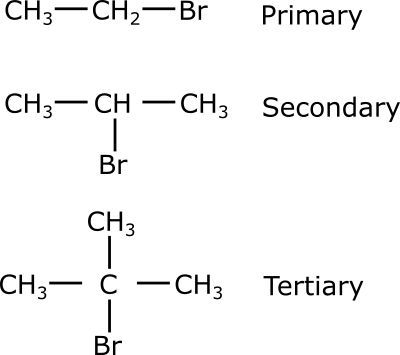
Алкилгалогениды классифицируются в зависимости от расположения атома галогена в цепи атомов углерода. Первичные, вторичные и третичные алкилгалогениды — это три типа алкилгалогенидов. Классификация алкилгалогенидов обычно используется для выявления закономерностей и тенденций в химической реакционной способности алкилгалогенидов. Что касается электроотрицательности, то галогены более электроотрицательны, чем углероды. Углерод и галоген всегда имеют одну связь, поскольку нейтральная связь для галогенов — это одна связь и три одинокие пары.
Схема, показывающая упрощенную химическую структуру первичных, вторичных и третичных алкилгалогенидов брома
Источник: study.com
Галогениды первичных алкилов
Углерод, связанный с атомом галогена в первичном (1°) галоалкане, соединен только с одной другой алкильной группой.
Сложность присоединенной алкильной группы не имеет значения. В каждом случае существует только одна связь с алкильной группой от группы CH2, которая удерживает галоген. Несмотря на отсутствие алкильных групп, связанных с углеродом, на котором находится галоген, CH3Br и другие метилгалогениды иногда рассматриваются как первичные алкилгалогениды.
Вторичные алкилгалогениды
Этот углерод непосредственно соединен с двумя дополнительными алкильными группами, которые могут быть одинаковыми или разными, во вторичном (2°) галоалкане.
Третичные алкилгалогениды
В третичном (3°) галогеноалкане галоген непосредственно связан с тремя алкильными группами, которые могут быть одинаковыми или разными. Эти химические вещества являются третичными алкилгалогенидами.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так