Изотермический процесс: графики, формула, примеры
Какой процесс называется изотермическим
Изотермическим процессом в термодинамике называют такой изопроцесс, течение которого можно наблюдать в рамках физической системы при неизменном температурном режиме.
Условием реализации изотермического процесса является наличие в системе термостата. Это крупное тело, которое пребывает в состоянии теплового равновесия. Термостат характеризуется высокой теплопроводностью. В результате повышается скорость обмена теплом с системой по сравнению со скоростью реализации процесса, а также температурный режим в рассматриваемой системе почти равен аналогичным показателем термостата.
Другой вариант осуществления изотермического процесса предполагает использование источников или стоков тепловой энергии. При этом стабилизируется температурный режим с помощью термометров. В качестве изотермических процессов, к примеру, идентифицируют кипящие жидкости и плавление материалов в твердом агрегатном состоянии в условиях стабильного давления. Изотермический процесс изображают в виде изотермы.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Какой закон описывает изотермический процесс
Закон Бойля-Мариотте: в газообразном веществе, которое называют идеальным газом, при стабильной массе не меняется результат умножения давления на объем:
\(P*V=const\)
Исходя из записанного соотношения, можно вывести уравнение, описывающее параметры системы, когда меняются объем, либо давления. Таким образом:
\(P_{1}*V_{1}=P_{2}*V_{2}\)
В данном случае \(P_1 \) и \(P_2\) показатели давления в начальный и конечный моменты течения процесса;
\(V_{1}\) и \(V_{2}\) демонстрируют объем в начальный и конечный моменты течения процесса.
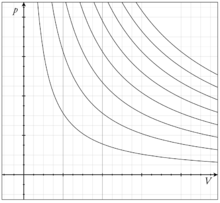
Если на плоскости изобразить координатные линии и обозначить их p и V, то изотермический процесс при переносе на график примет вид гипербол.
Реализация изотермического процесса предполагает приобретение или отдачу системой какого-то объема тепла Q, а также совершение рассматриваемой системой работы А, приложенной к внешним объектам. В другой ситуации при отсутствии теплового обмена с внешней средой система с точки зрения термодинамики пребывает в состоянии уравновешенной энергии, то есть не предусмотрено поглощение или выделение теплоты. Такой процесс называют адиабатическим.
Формула для вычисления работы, которую совершает идеальный газ в процессе изотермии:
\(А = N\,k\,T\,\ln(V_{2}/V_{1})\)
Здесь N отображает количество частиц в газообразном веществе, T характеризует температурный режим, k обозначает постоянную Больцмана, \(V_{1}\) и \(V_{2}\) являются объемами газа, когда процесс только начался, и в его конце.
Материалы в твердом агрегатном состоянии и большинство жидкостей сохраняют стабильность объема, либо минимально его меняют, участвуя в изотермических процессах. Это обстоятельство меняется в случае возникновения фазового перехода.
Первый закон термодинамики для изотермического процесса предполагает стабильность внутренней энергии системы в изотермическом процессе, то есть: Q=A
В результате общий объем тепла, который получила система, тратится на выполнение рассматриваемой системой работы, приложенной к внешним объектам.
Кто открыл изотермический процесс
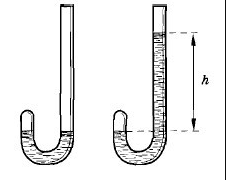
С разницей в 14 лет открытия закона, характеризующего изотермический процесс, совершили Роберт Бойль (1662 г.) и Эдм Мариотт (1676 г.). Наблюдения Бойля над тем, как меняется объем воздушной среды в рамках длинной изогнутой трубки с ртутью.
По наблюдениям Бойля при идентичных уровнях ртути в трубках воздушное давление соответствует значению атмосферному, то есть 760 мм рт. ст. При добавлении ртути в длинное колено емкости Бойль наблюдал уменьшение в два раза объема воздуха при равной разности уровней (h=760 мм). Исходя из этого, имеет место двойное увеличение давления воздуха. Таким образом, ученый пришел к выводу о наличии обратной пропорциональной зависимости между объемом газовой массы и его давлением.
Совершенное открытие было подтверждено многочисленными экспериментальными опытами, которые заключались в анализе изменения системы при увеличении количества ртути в разных пропорциях. Независимо от экспериментальной деятельности Бойля, ученый из Франции Эдм Мариотт сформулировал такую же закономерность. В результате данное соотношение назвали «Закон Бойля-Мариотта».
Закон Бойля-Мариотта: давление некой массы газообразного вещества при стабильном температурном режиме находится в обратно пропорциональной зависимости от объема газа.
Формула, графики, уравнение
Некоторое количество изотерм для идеального газа нa p-V диаграмме:
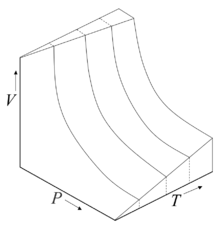
Некоторые изотермы для идеального газа нa p-V-T диаграмме:
Заметим, что при изотермическом процессе масса газообразного вещества не меняется, а температурный режим сохраняет стабильность.
Сформулируем соотношения для пары состояний идеального газа:
\(p_1V_1=\nu RT\)
\(p_2V_2=\nu RT\)
Выполним деление второго уравнения на первое выражение, чтобы получить соотношение изотермического процесса:
\(\frac{p_2V_2}{p_1V_1}=1\)
\(pV=const\)
Процесс состоит в увеличении объема при поступлении теплоты и уменьшении объема при отводе теплоты. С помощью записи первого начала термодинамики выведем соотношение для вычисления работы, внутренней энергии и количества тепла в случае изотермического процесса:
\(\delta Q=dU+dA=\frac{i}{2}\nu RdT+pdV\)
Стабильность температуры позволяет сделать вывод о нулевом значении изменения внутренней энергии:
\(dU=0\)
Таким образом, общий объем поступающей теплоты в условия течения изотермического процесса расходуется на совершении работы газообразным веществом:
\(\triangle Q=\int\limits^{V_2}_{V_1}{dA}\)
В данном случае \(\delta Q\) является простейшим теплом, которое поступает в систему, dA обозначает простейшую работу, совершаемую газом при изотермическом процессе, i отображает количество степеней свободы молекулы газа, R обозначает универсальную газовую константу, d является количеством молей газа, \(V_1\) представляет собой объем газа в начальный момент, \(V_2\) представляет собой объем газа в конечный момент.
Запишем справедливое равенство, выражающее величину работы:
\(A=\int\limits^{V_2}_{V_1}{pdV}\)
Вычислить давление можно путем выражения его значения из уравнения состояния, в котором пребывает идеальный газ:
\(pV=\nu RT\to p=\frac{\nu RT}{V}\)
Путем объединения полученных выражений получим следующее соотношение:
\(A=\int\limits^{V_2}_{V_1}{\frac{\nu RT}{V}dV}=\nu RT\int\limits^{V_2}_{V_1}{\frac{dV}{V}}=\nu RTln\left(\frac{V_2}{V_1}\right)\)
Воспользуемся законом Бойля-Мариотта:
\(A=\nu RTln\left(\frac{p_1}{p_2}\right)\)
\(\triangle Q=A\)
Таким образом, определено количество тепла, которое получает газ массой m при течении изотермического процесса.
Примеры задач
В системе имеется некоторое количество идеального одноатомного газа. Вещество расширяется в условиях стабильного температурного режима:
\(V_1=0,2\ м^3\)
\(V_2=0,6\ м^3\)
Второй объем характеризуется давлением:
\(p_2=1\cdot {10}^5\ Па\)
Требуется вычислить следующие параметры системы:
- изменение внутренней энергии газа;
- работу, совершаемую газом;
- количество тепла, передаваемого газу.
Решение
Обратимся к понятию изотермического процесса. Заметим стабильность внутренней энергии газа. На основании этого утверждения запишем следующее равенство:
\(\triangle U=0\)
Согласно первому началу термодинамики, справедливым является следующее соотношение:
\(\triangle Q=A\ \left(1.1\right)\)
\(A=\nu RTln\left(\frac{V_2}{V_1}\right)\left(1.2\right)\)
В конечный момент времени идеальный газ принимает состояние, которое допустимо записать с помощью такого выражения:
\(p_2V_2=\nu RT\to T=\frac{p_2V_2}{\nu R}\ \left(1.3\right)\)
Путем подстановки соотношения для температуры в полученные равенства выполним следующие преобразования:
\(A=\nu R\frac{p_2V_2}{\nu R}ln\left(\frac{V_2}{V_1}\right)=p_2V_2ln\left(\frac{V_2}{V_1}\right)\left(1.4\right)\)
Выполним вычисления:
\(A=0,6\cdot {10}^5ln\left(\frac{0,6}{0,2}\right)=0,6\cdot {10}^5\cdot 1,1=6,6{\cdot 10}^4(Дж)\)
Ответ: внутренняя энергия не меняется; работа составляет \(6,6{\cdot 10}^4Дж\); количество тепла равно \(6,6{\cdot 10}^4Дж.\)
Имеется какое-то количество газообразного вещества, начальная температура которого составляет \({37}^\circ C\). Требуется вычислить значение температурного режима, до которого необходимо изобарически охладить рассматриваемый объем газа для его уменьшения на ¼.
Решение
В данном случае речь идет об изобарном процессе. Исходя из этого, можно прийти к следующему выводу:
\(\left(p=const\right)\)
Система функционирует определенным образом, согласно закономерности Гей-Люссака:
\( \frac{V_1}{T_1}=\frac{V_2}{T_2}\)
Обратимся к условиям задания. Имеет место изобарное понижение температуры на ¼. Таким образом:
\(V_2=\frac{3}{4}V_1\)
В результате получим следующее соотношение:
\(\frac{V_1}{T_1}=\frac{\frac{3}{4}V_1}{T_2}\)
Окончательное значение температурного режима целесообразно вычислить таким образом:
\(T_2=\frac{3}{4}T_1\)
Выполним приведение единиц измерения в СИ:
\(T_1={37}^\circ C=310\ K\)
Проведем соответствующие вычисления и запишем окончательный ответ:
\(T_2=\frac{3}{4}\cdot 310=233\ K\)
Ответ: \(233\ K.\)
Существует кислородная среда в составе инженерной системы в самолете. Объем кислорода составляет \(2,8\cdot {10}^{-3}\ m^3\). При этом газ находится под давлением \(2\cdot {10}^7\) Па. В процессе увеличения высоты полета воздушного судна требуется с помощью задвижки соединить рассматриваемую систему и опустошенную емкость, объем которой составляет \(5\cdot {10}^{-2}\ m^3\). Температуры стабильна. Требуется вычислить величину давления в системе.
Решение
Согласно условиям задания, имеет место изотермический процесс. По этой причине целесообразно записать следующее справедливое соотношение:
\(\left(T=const\right)\)
Воспользуемся законом Бойля-Мариотта, который выражен таким образом:
\(p_1V_1=p_2\left(V_1+V_2\right)\)
Исходя из полученного равенства, рассчитаем, чему равно новое значение давления:
\(p_2=\frac{p_1V_1}{V_1+V_2}\)
Выполним соответствующие вычисления путем подстановки численных значений:
\(p_2=\frac{2\cdot {10}^7\cdot 2,8\cdot {10}^{-3}}{2,8\cdot {10}^{-3}+5\cdot {10}^{-2}}=7,2\cdot {10}^6\ Pa\)
Ответ: \(7,2\cdot {10}^6 Па.\)
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так