Изохорный процесс: формула, графики, уравнения
Какой процесс называется изохорным
В термодинамике существует несколько типов процессов, которые могут происходить в условиях, когда масса (m) газов (которые рассматриваются как физический объект для этих исследований) всегда остается постоянной, но иные параметры состояния могут изменяться. Параметры состояния включают давление, объем, температуру и энтропию. Так, в зависимости от того, какой параметр системы сохраняется неизменным, в ходе этого процесса я разделяю четыре их типа: 1) изотермический процесс (низкая или высокая температура сохраняется постоянной), 2) изобарный процесс (разное давление сохраняется постоянным во время всего процесса, выполняемого с системой), 3) изохорный (объем удерживают постоянным на протяжении всего процесса) и 4) адиабатический (постоянная энтропия, то есть отсутствует обмен со средой вокруг физического процесса ни теплом, ни веществом).
Изохорный процесс — это процесс видимого изменения разного состояния в рабочей термодинамической системе видимых тел, значимый процесс идет при держании его в постоянном объеме (V=const).
Макроскопические тела — это тeла, которые рассматриваются в определении изохорного процесса, обычно включают газы и жидкости. Так, для таких макроскопических тел, если необходимо проводить процесс изохорно, то необходимо нагревать/охлаждать или изменять давление, но при этом соблюдать условие — объем должен оставаться неизменным.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Кто открыл изохорный процесс
Первым, кто проводил испытания над идеальным газом, который использовался как модельная система, при этом были созданы условия в системе, чтобы объем газа оставался постоянны, был французский физик Гийом Амонтон. Первые испытания в такой системе, которые он проводил, были опубликованы им в 1702 году в «Парижских мемуарах». В этой работе были указаны условия проведения данного эксперимента, то есть модель — это идеальный газ, были соблюдены условия, чтобы его объем не менялся, а также важным условием было то, что система была помещена в "стабильный воздушный термометр". В ходе своего эксперимента Амонтон заметил, что при стабильном нагревании давление газа увеличивалось с увеличением T (пропорционально), а жидкость по чуть-чуть вытеснялась веществом в газовой форме и переходила в идущую дальше выступающую колонну, заполняя ее.
Изучение важного для науки изохорного процесса не остановилось на экспериментах Амонтона, его будущее предопределил физик из Англии — Джон Дальтон в 1801 году. Он провел ряд экспериментов, с помощью них удалось выяснить, что при одних и тех же начальных и конечных, т.е. при стабильных давлениях, при варьировании температуры газы сжимаются/расширяются. Третьим важным этапом в изучении интересного изохорного процесса стало овладевание этм процессом французским физиком Жозефом Луи Гей-Люссаком. Он провел собственное независимое исследование, в результате которого эксперименты Далтона ознаменовались как подтвержденыt. А позже Гей-Люссак смог объединить свои выводы с уже известным зависимостью Бойля–Мариотта, именно в результате этой комбинации был подробнейшим образом описан изохорный процесс, где модельной системой является идеальный газ. А правило, описывающее зависимости V газа от T для изохорного процесса было названо в честь исследователя, то есть вторым законом Гей-Люссака. Иное название "закон Шарля" ему дал экспериментатор, приложивший руку к открытию этого уложения, а именно в 1787 году Шарль с помощью эксперимента проверил зависимость давления газа от температуры при поддержании в системе одинакового объема газа, и только после этого в 1802 году Гей-Люссак дополнил этот закон термодинамики.
Условия протекания изохорного процесса
Первым и наиболее важным для реализации процесса — это нахождение ТД системы в замкнутой системе (сосуде или пространстве), чтобы объем в течение всего процесса оставался неизменным. Второе - исследуемое вещество должно находиться в закрытой системе, чтобы не было обмена системы веществом или теплом с окружающей средой (воздухом и т.д.) для простого описания процесса, а также для разработки и вывода более корректных данных. Третьим условием, важным для того, чтобы поток обрабатывался при V = const, является постепенное изменение (повышение/ понижение) градуса в системе.
Формулы, графики, уравнения
Закон Шарля (второй закон Гей-Люссака). Давления интересующего газа постоянной массы при соблюдении постоянного (const) исследованного объема прямо пропорционально температуре газа.
\(P\;\sim\;T\)
\(pV\;=\;\frac mMRT\;=\;nRT\), где m — масса газа(кг), M — молекулярная масса газа(кг/моль), R = 8,314 Дж/(моль*К) — универсальная газовая постоянная, T — температура (К), n — количество молей газа.
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)
Что означает тоже самое, что
\(\frac pT=const\)
То есть отношение давления к температурев ходе всего процесса остается неизменяемым.
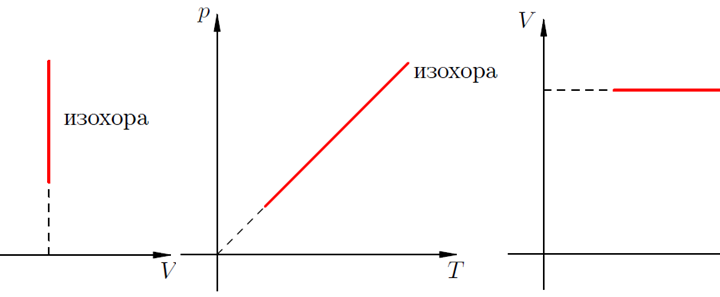
Исходя из того факта, что для изопроцессов с постоянным объемом давление газа в системе прямо пропорционально температуре, то эту зависимость можно представить на графиках для представления. Более того, принято строить графики в разных координатах переменных параметров состояния (давления, температуры и объема), следовательно, существует три типа графиков в разных координатах: p-V, p-T и V-T (рис.1). На любом из этих графиков объем лишается возможным меняться, потому что мы рассматриваем изохорный процесс, а линия графика зависимости называется изохорой.
Рис.1. Графики зависимостей для изохорного процесса в различных координатах.
Количество теплоты при изохорном процессе
Определяется из I Закона ТД, который звучит следующим образом (пока что без наложения условия, что объем газа неизменный), а также при условии, что работу делает сама система, а не внешние силы над системой:
Количество теплоты, полученное системой, расходуется на изменение внутренней энергии и совершения системой работы над внешними силами (телами и т.д.)
\(\triangle U= Q — A \)
Когда мы работаем в системе с стабильным объемом, то есть протекает изохорный процесс, то I начало термодинамики приобретает некоторые ограничения, первое из которых — это то, что работа, которую совершает система в изохорном процессе, будет равна нулю:
\(A\;=\;p\ast\triangle V\;=0\)
Таким образом, работа в ходе изопроцесса с постоянным объемом не совершает работы.
Тогда количество теплоты, которое мы определяли по I закон термодинамике будет равно только чувствительным колебаниям внутренней энергии системы:
\(\;Q=\triangle U\)
Внутренняя энергия при изохорном процессе
Варьирование внутренней энергии — это разница между значениями начальной уникальной внутренней энергии системы и конечной важной. То есть однажды при начальной температуре системы и при якобы конечной температуре у нас будут два разных значения внутренней энергии, откуда мы получим формулу: \(\triangle U\;=U(T_2)-U(T_1)=\;Q\;\)
Откуда еще раз видно, что количество тепла системы в изохорном процессе будет определяться только изменением внутренней энергии системы, а именно ее начального и конечного состояний.
Примеры
Цикл Отто — это процедура физической стороны, в которой действуют законы термодинамики. В ней описываются манипуляции всего процесса, который выполняет двигатель внутреннего сгорания (ДВС) с воспламенением и последующим воспламенением сжатой смеси от стороннего источника энергии – это цикл, по которому работают все бензиновые двигатели.
Теоретически немецкий инженер То, работая над этим циклом, создал идеальные условия, при которых цикл состоит из четырех этапов - процессов, показанных на рисунке 2:
1-2 стадия адиабатического сжатия рабочего тела
2-3 стадия изохорной подачи тепла к рабочему телу
3-4 стадия адиабатического расширения тела
4-1 стадия охлаждения рабочего тела при постоянном объеме
Также изохорный процесс часто используют для решения физических задач, используя для этого модельные системы. Рассмотрим несколько задач, где используется перводокакзанный закон термодинамики и закон Шарля.
Вещество в газовой форме располагается в баллоне при температуре 400 К. До какой температуры нужно разогреть газ, чтобы его давление выросло в 1,5 раза?
Решение:
Так как разогрев газа по условиям данным нам в задачи идёт при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
\(\frac pT=\;const\)
Откуда
\(\begin{array}{l}\frac{p_1}{T_1}=\frac{\displaystyle p_2}{\displaystyle T_2}\;\\\\\end{array}\)
\(\begin{array}{l}T_2=\;\frac{\displaystyle p_2T_1}{p_1}\\\\\end{array}\)
\(\begin{array}{l}\frac{p_2}{p_1}=1.5\\\\T_2=1.5\ast T_1\;=1.5\ast400\;=\;600\;K\end{array}\)
Ответ: 600 К.
Определите количество теплоты, которое нужно затратить на нагрев 8,5 г аммиака от 25 до 40 \({}^\circ С\) при постоянном объеме.
Решение:
Аммиак имеет следующую химическую формулу — NH_3. С помощью таблицы Менделеева рассчитаем его молекулярную массу:
\(M(NH_3)\;=\;M(N)\;+3\ast M(H)\;=\;14\;+\;3\ast1\;=\;14\;+3\;=\;17\;г/моль.\)
Количество теплоты, которое система получает при стабильном объеме, то есть в ходе изохорного процесса (по условию), можно рассчитать следующим образом:
\(Q_p=n\ast C_v\ast\triangle T=n\ast C_v\ast(T_2-T_1)\;=\;\frac{m(NH_3)}{M(NH_3)}\ast C_v\ast(T_2-T_1).\)
Для определения C_v –теплоемкости газа необходимо вспомнить, что аммиак — это химическое вещество, геометрия которого — треугольная пирамида. Таким образом, молекулярная теплоемкость идеального газа для изохорного процесса без учета колебательных степеней свободы (потому что низкие температуры, и они заморожены) для нелинейной многоатомной молекулы будет равно:
\(C_v=3\ast R\)
Подставляем все известные значения в формулу нахождения количества теплоты и находим ее значение:
\(Q_p=\frac{8,5}{17}\ast3\ast8,314\ast(40-25)\;=\;0.5\ast3\ast8.314\ast15\;=\;187\;Дж\\\)
Ответ: 187 Дж теплоты будет затрачено системой на нагрев от 25 до 40 \({}^\circ С\) при постоянном объеме.
Заметили ошибку?
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так